

英文标题:Spatial and single-cell expression analyses reveal complex expression domains in early wheat spike development
中文标题:空间和单细胞表达分析揭示小麦穗早期发育中的多元表达模式
发表期刊:Genome Biology
影响因子:9.4
研究背景
小麦(wheat)是全球粮食安全的关键作物,2023年统计全球小麦产量约为 7.99 亿吨。籽粒在穗部中发育使得提高穗部生产力成为一项重要的育种目标。传统育种与分子育种手段虽已取得一定进展,但穗部产量的提升幅度有限。
麦穗的发育始于顶端分生组织(SAM)向花序分生组织(IM)的转变,SAM 负责产生叶片,而 IM 则负责产生麦穗。多个基因家族在此过程中扮演关键角色。
近年来,单分子荧光原位杂交(smFISH)和单细胞转录组测序(scRNA-seq)技术的发展,为在空间分辨率和单细胞分辨率下系统解析复杂器官发育过程提供了革命性工具。
本研究首次在小麦中整合单分子荧光原位杂交与单细胞测序,系统绘制了穗早期发育的细胞图谱与表达域,为解析穗发育调控网络提供了高分辨率的时空表达数据。
研究结果
1.构建小麦穗早期发育的多元空间表达域与单细胞簇
本研究通过整合高分辨率的单分子荧光原位杂交(smFISH)与高通量的单细胞 RNA 测序(scRNA-seq),首次在小麦穗早期发育过程中构建了细胞分辨率的空间基因表达图谱。
本研究首先通过 smFISH 技术,在三个早期发育阶段(W1.5 初始转变期(图1A)、W2.5 双脊后期(图1B)、W3.5 小花原基期(图1C))对 48,225 个细胞中 99 个基因的表达进行了高分辨率空间定位,鉴定出 21 个具有独特基因表达谱的空间细胞簇。
这些簇在不同发育阶段和小穗间表现出高度可重复性,并涵盖了从穗基部居间分生组织、花序分生组织(IM)、小穗分生组织(SM)到花分生组织(FM)的所有关键区域。
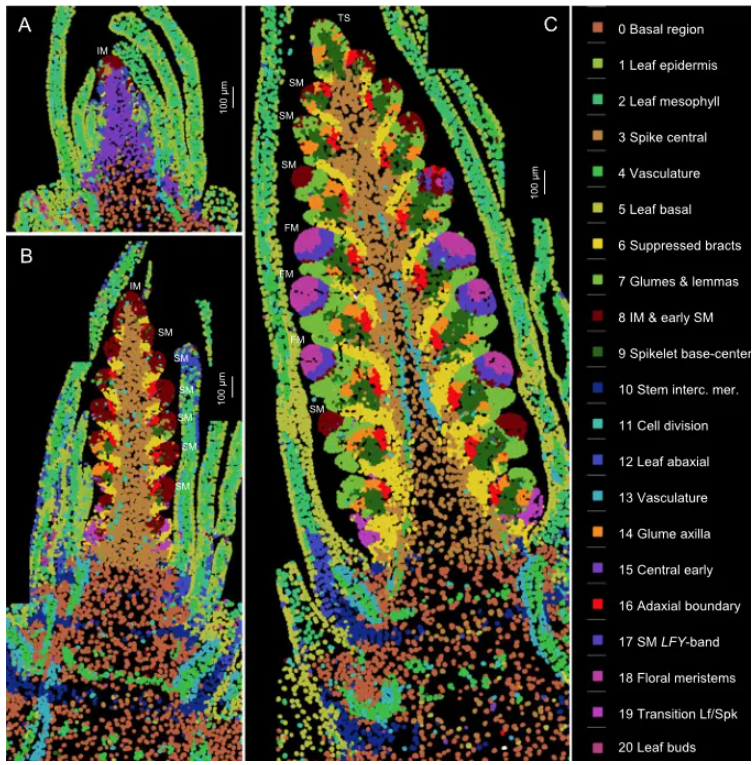
图1. 基于 smFISH 分析的小麦穗发育三个阶段的细胞聚类图
2.簇穗基部区域:鉴定居间分生组织
smFISH 空间图谱揭示在穗基部的未来节间区域,发现了一个特异的细胞带(c10 簇)(图2B),高表达 LFY、PLATZ1、SVP1 等基因(图2A),被鉴定为居间分生组织。研究表明,该区域并非简单的结构组织,而是重要的调控中心。
lfy 突变体茎节和节间显著增粗、中空结构减少,揭示了 LFY 在控制茎秆径向生长和充实度中的全新功能。同时,赤霉素合成(*GA20ox1/2*)与降解(GA2ox1)基因在该区域相邻细胞中呈现互补的空间分布,暗示局部激素梯度与 LFY 共同精细调控节间伸长。该发现将穗基部确立为协调营养生长与生殖发育的关键整合区域。
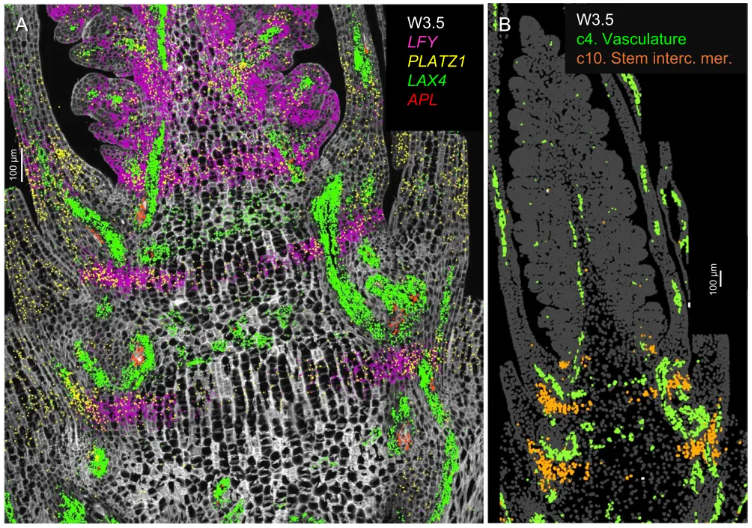
图2. W3.5 时期穗基部下区域的单分子荧光原位杂交(smFISH)表征
3.叶与穗的过渡区:解析苞叶抑制与花序身份确立的边界信号
小穗数(SNS)是产量的关键构成因子,受花序分生组织产生侧生分生组织的速率及其向顶生小穗转变(IM→TS)的时机共同调控。
在叶原基向花序的过渡区(c19簇)(图1B-C),研究发现了 SPL14/17、TB1、FUL2 等基因的富集。该区域充当了“发育开关”:其基因表达模式抑制了下方叶脊(苞叶)的发育,同时促进了上方小穗分生组织的形成。
CRISPR 突变体证实,SPL14 功能缺失导致花序基部苞叶的异位生长,验证了该区域在抑制苞叶、确立花序身份中的核心作用。该过渡区作为关键的发育边界,确保了分生组织命运从营养性向生殖性的正确转换。
4穗中心区域:阐明维管与光合组织的分工与连接
穗中心区域主要由基本组织(c3簇)和维管组织(c4, c13 簇)构成(图1B-C)。研究发现,PIN1a、PIN1b、LAX4 等生长素运输蛋白在维管前体细胞中特异表达(图3A-C),预示着早期维管模式的建立。
同时,中心基本组织在发育早期即呈现绿色,并高表达光合作用相关基因(如 CAB2R、LHCB1.1),表明其不仅提供结构支撑,更可能作为“光合引擎”,为快速发育的穗部提供碳源。该区域体现了运输系统(维管)与能量供应系统(光合组织)在空间上的精密协同。
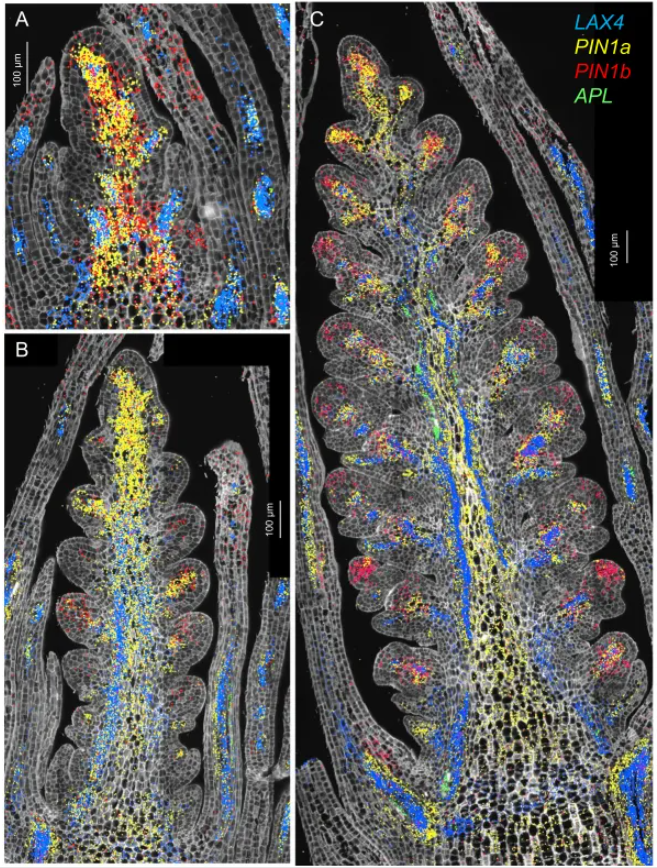
图3. 穗中心区域(细胞簇 c3)的单分子荧光原位杂交表征
5.小穗分生组织(SM)邻近区域:发现多层次边界信号中心
在穗基部研究解析出一个复杂的多层次调控区域:颖片/稃片原基(c7)、中央小穗基部(c9)、近轴边界(c16)和颖片腋部(c14)(图4)。
其中,FZP 在颖片腋部(c14)的特异表达至关重要(图4C-D)。CRISPR 敲除 FZP 导致腋生分生组织失控,产生嵌套颖片,完全破坏小花发育,证明该区域是抑制腋生分生组织、保证单花发育的“刹车”信号中心。
相邻的 TCP24 在近轴边界(c16)表达,其共表达网络包含 CUC3、LAX1 等保守的边界基因,共同构成一个调控小穗分生组织边界与器官模式的信号模块(图4A-D)。
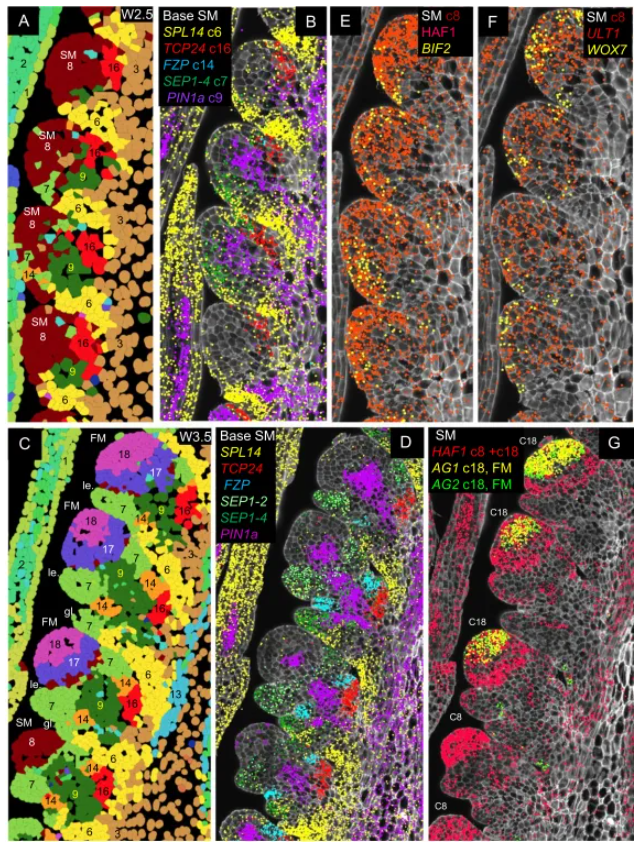
图4. 小穗分生组织邻近区域的特征:多组标记基因的 smFISH 表达谱
6.小穗分生组织(SM)与花分生组织(FM)区域:描绘花发育启动的时空路径
从花序分生组织(IM)到花分生组织(FM)的转变过程被清晰刻画:早期分生组织(c8簇)表达 BIF2、WOX7、ULT1(图4E-F);随着发育,AGL6 表达出现,标志向花分生组织的过渡;最终形成的花分生组织(c18簇)则激活 SEP3、AP3、AG 等花器官身份基因(图4G)。
特别值得注意的是,LFY 与 WAPO1 在花分生组织下方形成一个表达带(c17簇),两者的共表达区域为花器官的正确图式形成提供了关键的空间信息。
该区域动态展示了花序分生组织如何通过时序性基因激活,逐步特化为花分生组织。
7.花序分生组织(IM)向顶生小穗(TS)转变:识别决定小穗数的关键计时因子
聚焦花序分生组织向顶生小穗(IM→TS)的转变过程——该过程直接决定每穗小穗数,研究发现 SPL14 的表达在转变期间显著下降。
通过 CRISPR-Cas9 敲除实验证实,SPL14 功能缺失导致 IM 提前转变为 TS,穗的数量减少42%,同时植株增高、抽穗延迟。这表明 SPL14 是控制花序发育进程的关键“发育计时器” 。
结合轨迹与伪时间分析,研究再现了从 IM 经 SM 向 FM 的细胞状态连续演变路径,动态展示了基因表达的时序变化。
8.基于小麦穗发育过程的单细胞转录组测序
本研究通过单细胞 RNA 测序(scRNA-seq)对小麦穗发育关键时期(W2.5和W3.5)的细胞进行了系统性解析,结合 smFISH 空间数据,成功构建了高分辨率的单细胞转录组图谱,并实现了大规模基因表达的空间定位。通过对 26,009 个单细胞进行 scRNA-seq 分析(图5A),研究共鉴定出 23 个转录组特征各异的细胞簇(图5B)。
这些细胞簇经过多层次注释,涵盖了从分生组织、表皮、维管、基本组织到过渡区等多种细胞类型。研究特别去除了细胞周期相关的细胞簇,提高了生物学相关细胞类型的分辨率。利用 smFISH 数据提供的精确空间坐标,研究通过创新的表达插值方法,将 scRNA-seq 中检测到的 74,464 个基因的表达谱成功映射回空间细胞中(图5C)。数据已公开(NCBI BioProject PRJNA1199502),并提供了交互式 Shiny 应用与 3D UMAP 可视化工具。
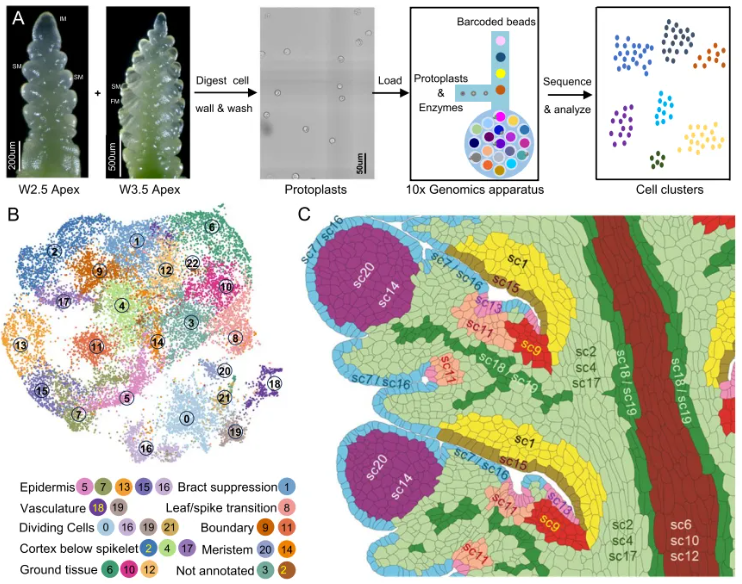
图5. 发育中小麦穗的单细胞转录组测序分析
9.单细胞簇表征与空间整合:实现细胞类型的空间定位
通过创新的“表达插值”方法,研究将 scRNA-seq 检测到的 74,464 个基因的表达谱成功映射回 smFISH 定义的空间细胞中,并反向将空间簇标签投射至单细胞。整合分析实现了细胞簇的空间注释、验证未知标记基因的空间表达和区分同源基因表达。
10.共表达分析与单细胞轨迹分析:挖掘调控网络与发育动态
基于单细胞数据,研究进行了深入的共表达与调控网络分析与单细胞轨迹分析。
针对 FZP、TCP24、ULT1、AGL6 等关键枢纽基因,在全基因组范围内筛选出高度共表达的基因集。并利用 GENIE3 构建了以 FZP 和 TCP24 为核心的基因调控网络,揭示了二者通过共享靶标(如 CUC3)在边界域功能的潜在协同。基于早期分生组织簇(sc14)构建了细胞分化轨迹图。
轨迹显示,分生组织细胞早期即与表皮命运关联,并随后分化为两条主要路径:一条通向维管与光合组织,另一条通向多种皮层与边界细胞类型。该轨迹直观再现了穗发育中细胞谱系分化的潜在路径。
研究小结
本研究整合单分子荧光原位杂交(smFISH)、单细胞测序(scRNA-seq)与功能基因组学方法,系统解析了小麦穗早期发育的细胞与分子调控全景。通过分析超过 4.8 万个细胞的空间基因表达,首次绘制了包含 21 个稳定表达域的时空图谱,精细定位了居间分生组织、叶-穗过渡区及小穗边界等多个关键调控枢纽。
功能验证揭示了重要基因的区室化功能:LFY 在居间分生组织调控茎秆构型,SPL14 作为发育计时器控制花序向顶生小穗转变从而决定小穗数,FZP 在颖片腋部抑制分生组织活性确保小穗确定性。
单细胞测序进一步鉴定出 23 个转录组特征各异的细胞簇,并通过创新的表达插值方法实现了 74,464 个基因表达谱的空间映射及细胞簇的精确解剖注释。
共表达分析与网络构建揭示了以 FZP 和 TCP24 为核心的边界调控模块,而细胞轨迹分析则动态再现了从分生组织向多种细胞类型分化的发育路径。
该研究建立了从空间图谱、细胞普查、数据整合到机制验证的多层次研究范式,所生成的高分辨率数据集与公开分析工具为小麦及禾本科作物穗发育研究与分子设计育种提供了核心资源与框架。
单细胞转录组测序:是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。
百趣生物空间转录组学:通过对样本包埋切片并与检测芯片结合,利用序列标签(spatial barcode和UMI)区别不同细胞的空间位置,可高效检测组织中空间原始位置上的基因表达模式,两者联合可同时获取细胞类型、功能及空间定位信息









