

文章标题:Microbiota-indole-3-propionic acid-heart axis mediates the protection of leflunomide against αPD1-induced cardiotoxicity in mice
发表期刊:nature communications
影响因子:15.7
客户单位:武汉大学人民医院
百趣提供服务:新一代代谢组学NGM 2 Pro、微生物16S扩增子测序、600MRM(现已升级为AQ700)
研究背景
黑色素瘤是一种高死亡率的恶性皮肤癌,近年来,免疫检查点抑制剂(如 αPD1)在黑色素瘤治疗中取得显著成效,但伴随严重的心脏毒性,如心肌炎和心肌病。尽管已有研究探索减轻心脏毒性的方法,但可能削弱 αPD1 的抗肿瘤效果。
来氟米特(Leflunomide, Lef)是一种临床用于治疗类风湿关节炎的免疫调节药物,可抑制肿瘤生长并减轻心脏重塑,但其对 αPD1 诱导的心脏毒性的作用尚不清楚。
本研究旨在探讨 Lef 对 αPD1 诱导的小鼠心脏毒性的保护作用及其潜在机制。
研究成果
01——Lef 治疗增强了 αPD1 介导的对黑色素瘤的免疫治疗疗效
为了研究 Lef 对 PD-1 抑制剂抗肿瘤特性的影响,研究人员将 B16-F10 细胞皮下移植到小鼠右侧腹部,并在小鼠腹腔注射 αPD1 或 IgG,同时给予 Lef 治疗 12 天(图 1A)。
结果显示,αPD1 治疗显著减小了肿瘤体积,而 αPD1 联合 Lef 治疗进一步降低了肿瘤体积(图 1B-C)。
此外,从肿瘤移植后 14 天开始,每隔一天给予小鼠 αPD1 腹腔注射,并在首次注射时开始每日 Lef 治疗,观察到 Lef 对黑色素瘤体积有显著的治疗效果。延长肿瘤接种时间至 45 天后,发现 αPD1 治疗降低了黑色素瘤小鼠的死亡率,且 Lef 增强了这种治疗效果。
流式细胞术分析显示,与对照组相比,αPD1 治疗增加了小鼠肿瘤组织中的 CD4+ 和 CD8+T 细胞数量,而 Lef 显著降低了 CD8+T 细胞数量,但不影响 CD4+T 细胞(图 1D)。
研究还发现,Lef 减少了 αPD1 处理小鼠的肿瘤增殖,但不影响肿瘤死亡,表明 Lef 增强了 αPD1 的抗肿瘤作用。
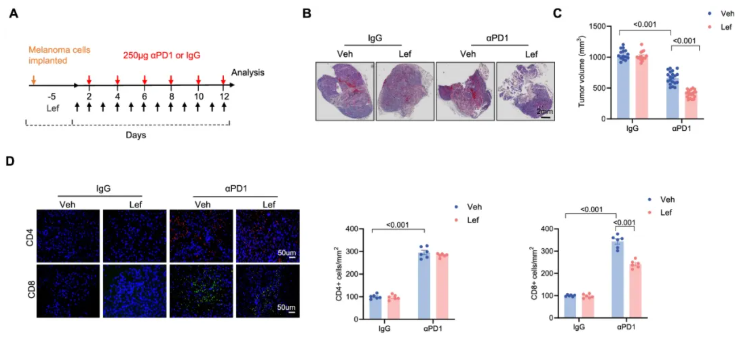
图1. Lef 增强了 αPD1 介导的对黑色素瘤的免疫治疗疗效
02——Lef 治疗减轻 αPD1 治疗的黑色素瘤小鼠的心脏毒性
αPD1 处理的黑色素瘤小鼠出现心功能受损,表现为射血分数(Ejection Fraction, EF)和短轴缩短分数(Fractional Shortening, FS)降低以及左心室舒张末期内径(Left Ventricular End-diastolic Internal Diameter, LVIDd)增加。Lef 治疗可预防这些病理改变,并改善心输出量(Cardiac Output, CO)(图 2A-D)。
整体纵向应变(Global Longitudinal Strain, GLS)和平均径向应变(Average Radial Strain, ARS)分析显示,Lef 可改善 αPD1 小鼠左心室功能(图 2E-G)。Lef 还减轻了 αPD1 诱导的心脏损伤,表现为降低的心肌肌钙蛋白 T(cTnT)和肌酸激酶同工酶(CK-MB)水平。
RNA 测序揭示 αPD1 组与 αPD1+Lef 组间存在 2490 个基因表达改变,其中差异表达基因(DEG)参与的 PI3K-AKT 信号通路等与组织保护相关(图 3A-B)。
进一步研究发现,Lef 减少了 αPD1 诱导的心脏组织中 CD8+T 细胞浸润,降低了促凋亡蛋白 Bax 的表达,增加了抗凋亡蛋白 Bcl2 的表达,显著抑制了 αPD1 诱导的心肌细胞凋亡(图 3C-E)。
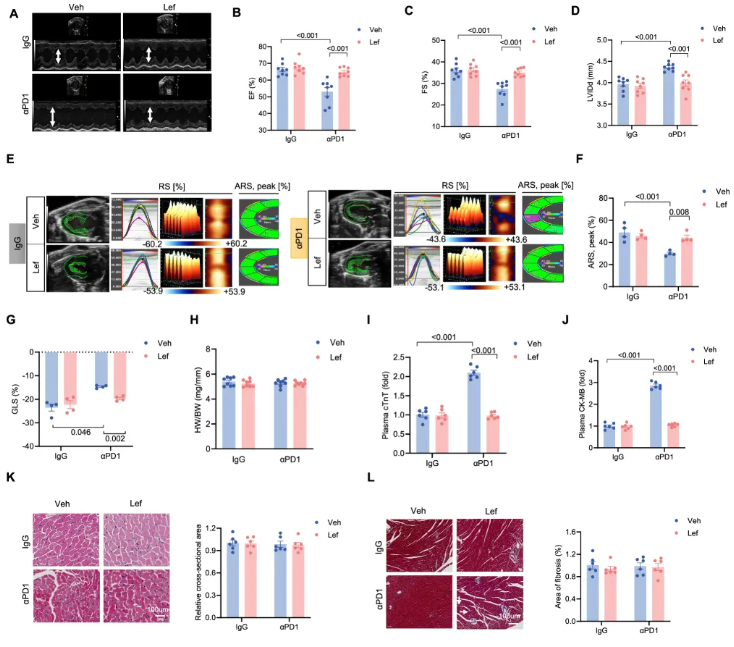
图2. Lef 减轻 αPD1 治疗的黑色素瘤小鼠的心脏毒性
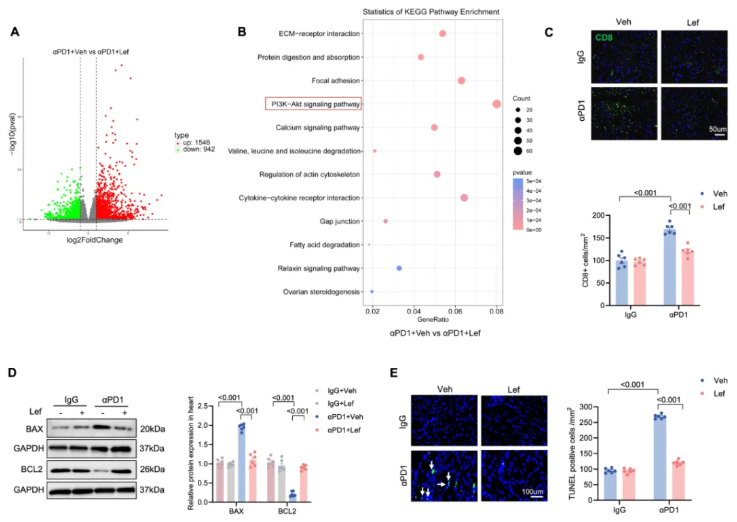
图3. Lef 有效抑制 PD1 抑制剂诱导的小鼠心肌细胞凋亡
03——Lef 对 αPD1 小鼠的心脏保护作用不依赖于 T 细胞
为了探究 CD8+T 细胞是否参与 Lef 对 αPD1 小鼠的心脏保护作用,研究者采用 CD8 单克隆抗体对 αPD1 处理的黑色素瘤小鼠进行 CD8+T 细胞耗竭实验。
免疫荧光检测证实 CD8+T 细胞已在心脏中有效耗竭,实验结果显示,即使在 CD8+T 细胞被耗竭的情况下,Lef 依然能够减轻 αPD1 治疗小鼠的心脏损伤和心功能障碍,表现为改善的 EF、FS,以及降低的 BNP mRNA 水平和 cTnT 浓度。
此外,研究还发现 Lef 的活性代谢产物 A77 1726 对分离自 αPD1 处理小鼠的成年心肌细胞活力无显著影响,表明 Lef 的心脏保护作用并非通过直接作用于心肌细胞或依赖 CD8+T 细胞实现。
04——Lef 治疗减轻 αPD1 小鼠肠屏障损伤,其心脏保护作用依赖肠道微生物群
研究者研究了 Lef 对 αPD1 治疗的黑色素瘤小鼠肠道损伤的保护作用,发现 Lef 可逆转 αPD1 引起的结肠缩短、肠绒毛丢失和杯状细胞减少,并增加紧密连接蛋白 occludin 和 ZO-1 的表达。
为验证 Lef 的心脏保护作用是否依赖肠道微生物群,研究者进行了粪菌移植(Fecal Microbiota Transplantation, FMT)实验(图 4A)。
结果显示,接受 αPD1+Lef 小鼠粪菌移植的小鼠,相比接受 αPD1 小鼠粪菌移植的小鼠,表现出更好的心脏功能(图 4B-D),且 BNP mRNA 水平(图 4E)和 cTnT 浓度(图 4F)更低,心肌细胞凋亡显著减少(图 4G),证实 Lef 的心脏保护作用是微生物群依赖性的。
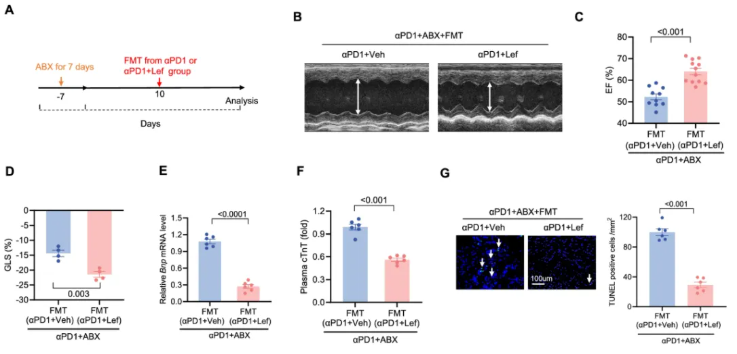
图4. Lef 改善 PD1 抑制剂诱导的小鼠肠屏障功能障碍和粪便移植的效果
05——Lef 治疗改变了 αPD1 治疗的黑色素瘤小鼠的肠道微生物丰度和群落结构
研究者通过 16S rRNA 测序分析了 Lef 对 αPD1 治疗的黑色素瘤小鼠肠道微生物组的影响,测序稀释曲线的 Goods coverage 指数显示测序深度充足(图 5A)。结果显示,αPD1+Lef 处理显著改变了肠道微生物群的 α 多样性(图 5B)和 β 多样性(图 5C)。
与对照组相比,αPD1 小鼠的厚壁菌门(Firmicutes)丰度显著降低,拟杆菌门(Bacteroidota)丰度明显增加(图 5D),属水平菌群丰度也呈现特征性变化,Sankey 图直观展示了各组间菌群分布的动态迁移(图 5E)。
Lefse 分析发现,αPD1 和 αPD1+Lef 组间存在显著的分类学差异,涉及副枝杆菌属(Paramuribaculum)、颤螺菌科(Oscillospiraceae)和乳杆菌属(Lactobacillus)等细菌(图 5F)。
进一步的相关性分析表明,这些特征细菌与心脏功能变化密切相关(图 5G)。
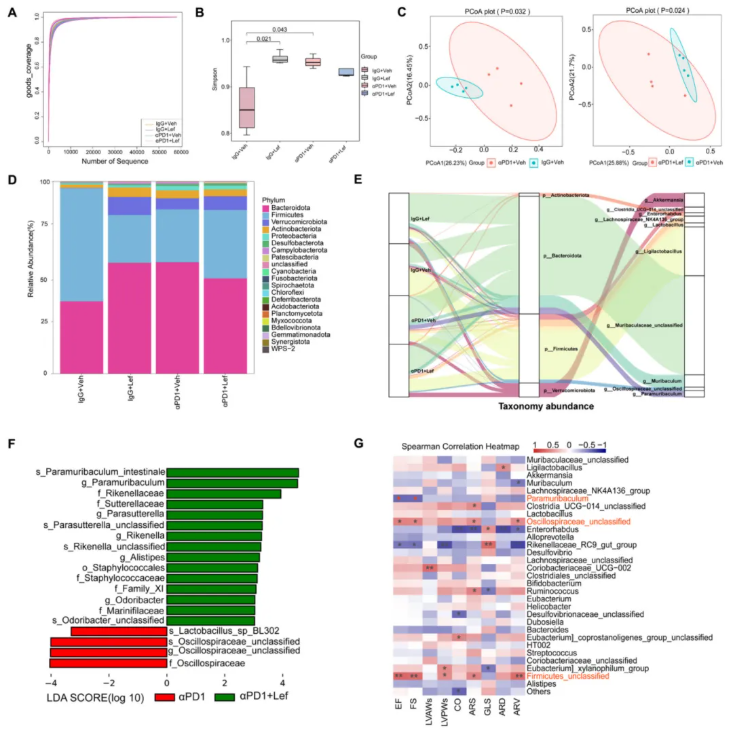
图5. Lef 治疗改变了 PD1 抑制剂治疗小鼠的肠道微生物丰度和群落结构
06——IPA 对 αPD1 处理的黑色素瘤小鼠的心脏毒性保护作用
研究者检测了小鼠血浆样本,发现脂质、有机酸及其衍生物和有机杂环化合物是主要的代谢物类别(图 6A)。
代谢物水平在不同组间存在显著差异,αPD1 组与对照组相比有 39 种代谢物差异(图 6B),而 αPD1 与 αPD1+Lef 组之间有 65 种代谢物显著改变(图 6C)。
代谢通路分析强调了色氨酸途径的重要性(图 6D)。通过色氨酸缺乏饲料实验,证实了色氨酸在 Lef 介导的心脏保护中的必要性——色氨酸缺失时,Lef 无法减轻 αPD1 诱导的心脏毒性(图 6E-F)。
16S rRNA 测序和代谢组学交叉分析揭示了 Lef 处理可逆转的 11 个差异属和 12 个差异代谢物的相关性(图 6G),其中吲哚-3-丙酸(IPA)作为唯一的色氨酸相关代谢物,与副枝杆菌属(Paramuribaculum)负相关,并在 αPD1+Lef 组中显著上调。
粪菌移植实验表明,接受 αPD1+Lef 小鼠微生物群移植的小鼠血浆 IPA 水平显著增加(图 6H)。
进一步的 IPA 补充实验(图 6I)显示,IPA 改善了 αPD1 治疗小鼠的心脏功能(图 6J),降低了 BNP mRNA(图 6K)和 cTnT 水平(图 6L),并抑制了心脏细胞凋亡。
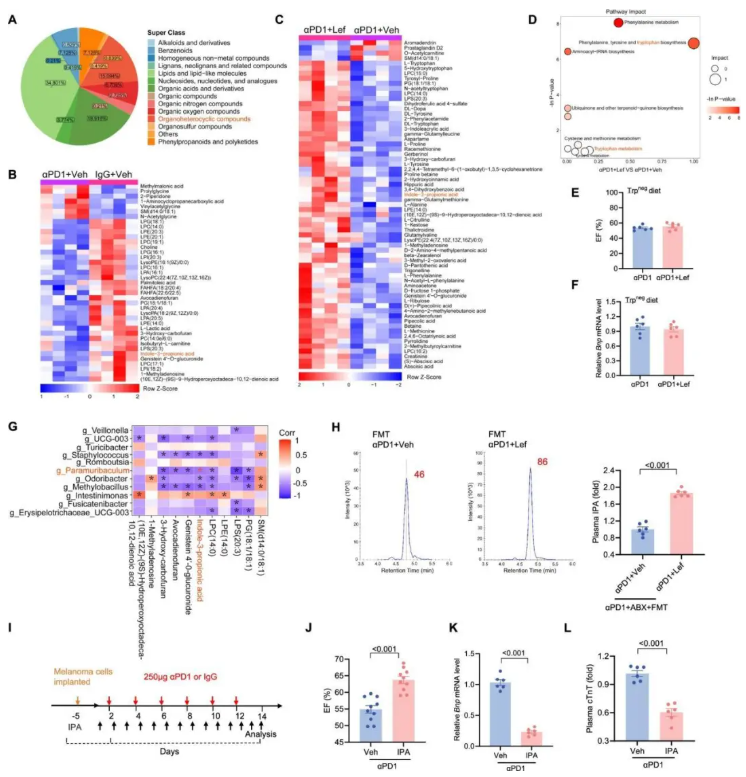
图6. IPA 对 αPD1 处理的黑色素瘤小鼠的心脏毒性保护作用
07——IPA 通过与 AhR 的配体结合促进心脏中 PI3K 的表达
孕烷 X 受体(Pregnane X Receptor, PXR)和芳香烃受体(Aryl Hydrocarbon Receptor, AhR)是两种 IPA 受体(图 7A)。心脏中不存在 PXR,而研究表明 AhR 在心血管疾病中起重要作用。
Western blot 结果显示,αPD1 抑制 AhR 及其靶基因细胞色素 P450 1A1(CYP1A1)的表达,而 IPA 则促进它们的表达,表明 IPA 处理的小鼠 AhR 活化状态增加(图 7A)。
为了研究 AhR 在 IPA 介导的 αPD1 诱导的心脏毒性保护中的作用,研究者用 shAhR 转染 αPD1 小鼠(图 7B),发现心脏 AhR 缺乏几乎消除了 IPA 的保护作用,导致射血分数(EF)和短轴缩短率(FS)降低,BNP mRNA 和 cTnT 水平升高(图 7C-F)。
此外,从 αPD1 处理的黑色素瘤小鼠中分离的成年心肌细胞实验表明,AhR 抑制剂 CH223191,而非 PXR 抑制剂白藜芦醇或 TLR4 抑制剂 IAXO-102,消除了 IPA 对 αPD1 诱导的心肌细胞损失的保护作用。

图7. IPA 通过 AhR 受体影响心脏毒性
为了揭示 IPA 的下游通路并更广泛地了解其对 αPD1 诱导的心脏毒性的影响,研究者对 RNA-seq 数据进行了 KEGG 通路分析。结果显示,PI3K-AKT 信号通路是最显著改变的通路。
研究发现,AhR 作为转录因子,通过特异性结合靶基因的 C(T)GCGTG 基序来发挥作用,且在 PI3K 催化亚基 α(Pik3ca)的启动子位点中鉴定到一个 AhR 结合位点(图 8A)。
ChIP-PCR 实验进一步证实,AhR 可直接结合 PI3K 催化亚基 α 的启动子区域(图 8B)。在 αPD1 处理的黑色素瘤小鼠中,PI3K 催化亚基 α mRNA 水平降低,而 Lef 或 IPA 补充使 IgG 或 αPD1 处理的黑色素瘤小鼠中的 PI3K 催化亚基 α mRNA 显著上调(图 8C-D)。
此外,Lef 或 IPA 补充还显著上调了总 PI3K 和磷酸化 PI3K(p-PI3K)的水平(图 8E)。PI3K 信号通路的下游组分,包括磷酸化 AKT(p-AKT)和磷酸化糖原合成酶激酶 3β(p-GSK3β),在 αPD1 处理的黑色素瘤小鼠的心脏中减少,而这些病理改变可通过 Lef 或 IPA 补充来预防(图 8E)。
为了建立 PI3K 与心肌细胞损失之间的因果关系,研究者对分离的心肌细胞进行了 PI3K 功能丧失实验。结果发现,PI3K 缺乏几乎消除了 IPA 对体外细胞活力的保护作用(图 8F)。这表明 PI3K 在 IPA 介导的心脏保护作用中起着关键作用。
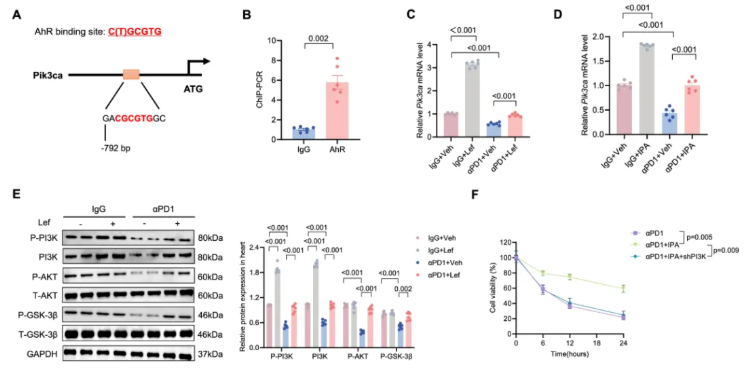
图8. IPA 通过心脏中 AhR 的配体结合促进 PI3K 的表达
研究总结
αPD1 免疫检查点阻断剂常联合其他疗法用于癌症治疗,但该治疗方案会引发心血管毒性。
研究发现,来氟米特(Lef)治疗可抑制 αPD1 相关的心脏毒性,且不影响 αPD1 介导的免疫治疗疗效。
具体而言,Lef 能改变 αPD1 治疗的黑色素瘤小鼠肠道微生物群的群落结构——与接受 αPD1 治疗小鼠微生物群移植的小鼠相比,接受 Lef+αPD1 治疗小鼠微生物群移植的小鼠具有更好的心脏功能。
从机制来看,作者通过代谢组学分析鉴定出吲哚-3-丙酸(IPA),该物质可保护 αPD1 治疗小鼠的心脏功能。IPA 能直接与芳香烃受体(AhR)结合,进而促进 PI3K 的表达,最终抑制心肌细胞凋亡,减轻免疫损伤引发的心脏毒性。
上述结果表明,Lef 通过调节微生物群-PA-心脏轴,有效减轻 αPD1 诱导的黑色素瘤小鼠心脏毒性。
新一代代谢组学NGM 2 Pro:凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。
微生物16S扩增子测序:基于二代测序平台靶向扩增微生物 16S rRNA 基因可变区,可高效解析样本中细菌 / 古菌的群落组成、物种丰度及分布差异;其通过提取样本总 DNA、靶向扩增目标片段、高通量测序等关键步骤快速获取菌群结构信息,广泛应用于肠道、土壤等各类含微生物样本研究,能为探究微生物与环境、宿主的互作关系(如肠道菌群与疾病、土壤菌群与作物生长)提供关键数据支撑。
AQ700高通量靶标定量:是一种高通量靶标代谢组学分析方法,可检测15类的600多种代谢物,涵盖生物体内关键代谢通路核心代谢物、肠道菌群相关代谢物以及文献中报道的生物标志物。这些代谢物在生理稳态维持、病理机制调控等多种健康与疾病状态中发挥关键作用。AQ700采用高灵敏度的三重四极杆质谱仪,能够在较短时间内对样本中600多种代谢物进行精准、快速的定性与定量分析,实现对样本代谢谱的全面解析。









