

文章标题:Proteomics of urinary exosomes for discovering novel non-invasive biomarkers of acute myocardial infarction patients
发表期刊:International Journal of Biological Macromolecules
影响因子:8.5
研究背景
急性心肌梗死(AMI)是全球范围内导致死亡和发病的主要原因,其发病突然,进展迅速,及时准确的早期诊断对改善患者预后至关重要。
目前临床上主要依赖血清心肌肌钙蛋白等生物标志物进行诊断,但这类检测存在明显局限性:一方面,肾功能不全患者的高敏心肌肌钙蛋白水平可能异常升高,干扰诊断结果;另一方面,血清检测属于有创操作,且传统血液生化检查和冠状动脉造影的敏感性有限、存在较高误诊率。
外泌体作为包裹信息分子的胞外囊泡,已被证实参与急性冠脉综合征(ACS)的病理生理过程,其携带的蛋白质、核酸等分子有望成为疾病生物标志物。尿液作为一种无创采集的体液,具有获取便捷、蛋白质稳定性高、样本量大等优势,但其来源的外泌体在 AMI 诊断中的应用尚未得到充分探索。
此前尚无研究明确 AMI 患者尿液外泌体中的特异性蛋白质标志物,且传统外泌体分离方法(如超速离心、体积排阻色谱法)存在纯度低、处理量受限等问题。
因此,本研究采用高效的 EXODUS 分离系统,结合蛋白质组学技术,旨在挖掘 AMI 患者尿液外泌体中的潜在无创生物标志物。
研究结果
本研究通过 EXODUS 系统分离 AMI 患者与健康对照者的尿液外泌体,经多维度表征、蛋白质组学分析及生物信息学验证,获得以下核心结果,各结果对应研究中的关键图表数据:
01-研究设计与样本处理
研究纳入 3 例 AMI 患者和 3 例健康对照者,首先通过心电图明确两组研究对象的临床诊断结果(图 1A),随后采集两组的清晨尿液样本(图 1B),经离心、过滤预处理后,采用 EXODUS 系统分离尿液外泌体(图 1C),再通过超滤管对分离得到的外泌体进行浓缩以满足后续实验需求(图 1D),之后对两组样本的外泌体蛋白质进行分析(图 1E),最后通过生物信息学分析挖掘两组间的潜在蛋白质生物标志物(图 1F),形成了完整且严谨的“样本采集-外泌体分离-蛋白质鉴定-标志物筛选”技术流程。
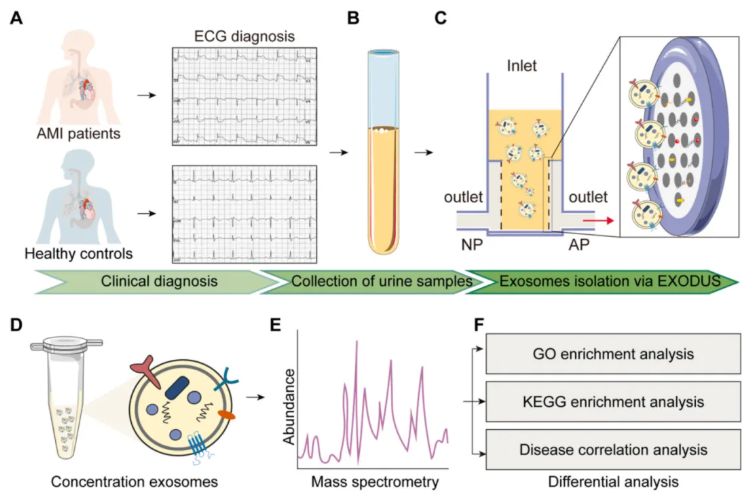
图1. 外泌体蛋白作为急性心肌梗死生物标志物的潜力研究
02-尿液外泌体的表征结果
纳米颗粒跟踪分析(NTA)显示,分离的外泌体呈单峰分布,峰值集中在 105 nm,主要粒径范围为 80-180 nm,符合外泌体典型尺寸特征(图 2A);AMI 组与健康对照组的外泌体平均粒径和众数粒径无显著差异(图 2B),但 AMI 组的外泌体颗粒数量显著高于健康对照组(图 2C)。
Western blot 结果显示,两组外泌体均表达经典标志物 Alix、HSP90、CD63、TSG101 和 CD81,且 AMI 组的多数标志物表达水平明显高于健康对照组,与 NTA 检测的颗粒数量差异一致(图 2D)。
透射电子显微镜(TEM)观察显示,两组外泌体均呈现典型的杯状形态,无明显形态学差异(图 2E-F),综合 NTA、Western blot 和 TEM 结果可证实通过 EXODUS 系统成功分离并获得了高质量的尿液外泌体。
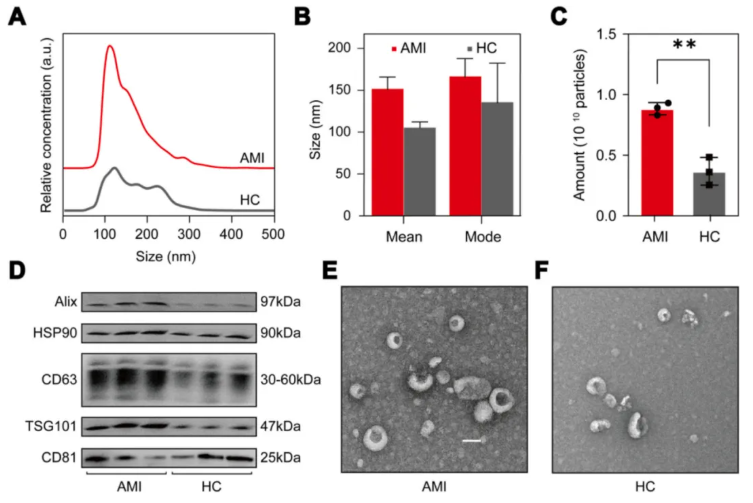
图2. 急性心肌梗死患者与健康对照者尿液外泌体的表征
03-尿液外泌体蛋白质组学特征
AMI 组与健康对照组的蛋白质色谱峰模式存在显著差异,AMI 组色谱峰呈现低丰度、密集分布特征,健康对照组则峰形尖锐清晰(图 3A)。
鉴定的蛋白质分子量主要集中在 20-200 kDa(图 3B)。共鉴定出 3194 种蛋白质,其中 3022 种为两组共有蛋白,AMI 组特有 36 种蛋白,健康对照组特有 102 种蛋白(图 3C)。
亚细胞定位分析显示,鉴定出的蛋白质主要来源于细胞质、分泌型蛋白和细胞核(图 3D)。GO 富集分析显示,共有蛋白在分子功能上富集于钙粘蛋白结合、磷脂结合,细胞组分上富集于细胞-基质连接、黏着斑,生物学过程上富集于中性粒细胞活化、脱颗粒等免疫相关通路(图 3E);KEGG 富集分析显示,蛋白主要参与肌动蛋白细胞骨架调控和内吞作用通路(图 3F)。
与外泌体数据库 Vesiclepedia 对比,本研究鉴定的外泌体蛋白覆盖率超过 90%,进一步证实了外泌体分离的高纯度。
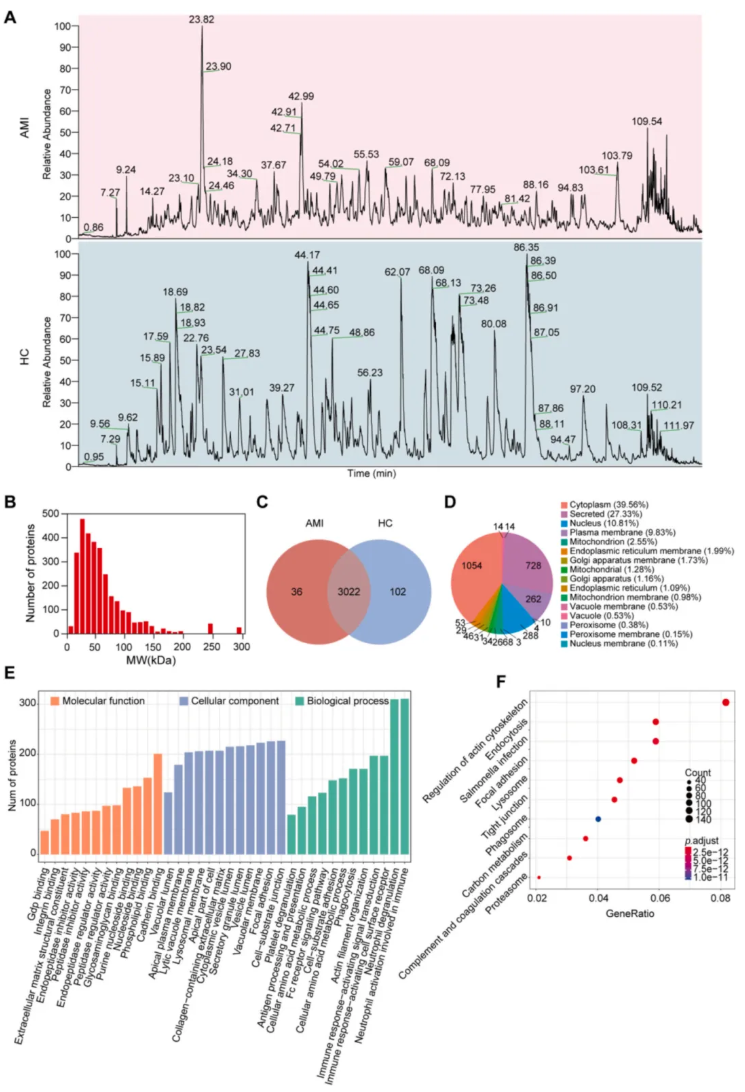
图3. 急性心肌梗死患者与健康对照者样本的蛋白质谱特征
差异蛋白筛选结果显示,共鉴定出 30 种差异蛋白,其中 17 种在 AMI 组上调,13 种下调,火山图和热图清晰展示了这些差异蛋白的表达特征(图 4A-B)。
亚细胞定位分析显示,差异蛋白主要来源于分泌型蛋白、细胞质和质膜(图 4C)。GO 富集分析显示,差异蛋白在细胞组分上富集于细胞外区域,分子功能上富集于钙离子结合,生物学过程上富集于细胞分化(图 4D);KEGG 富集分析显示,补体和凝血级联通路为显著富集的通路,这与 AMI 后血管损伤、凝血激活的病理过程高度一致(图 4E)。
通过 STRING 数据库构建的蛋白质相互作用(PPI)网络,揭示了差异蛋白间的潜在功能关联,为后续核心标志物的筛选提供了依据(图 4F)。
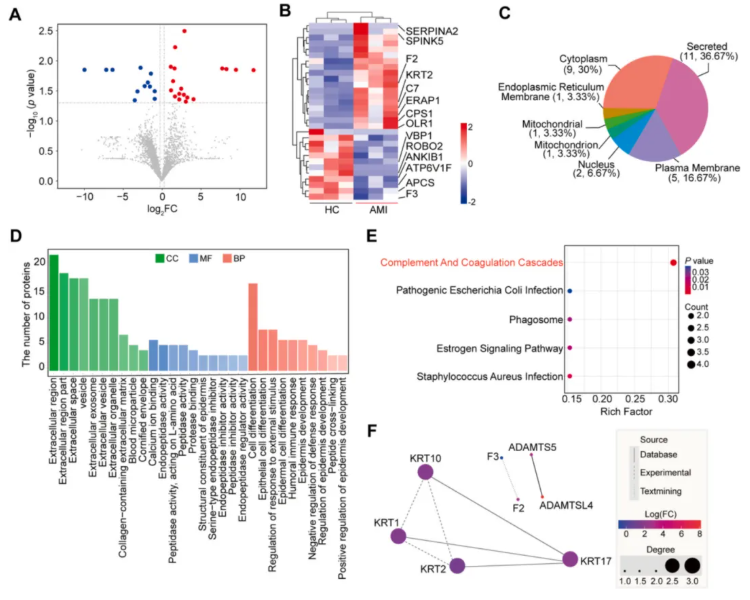
图4. 急性心肌梗死患者与健康对照者的差异蛋白分析
04-疾病关联与候选生物标志物
对 30 种差异蛋白对应的编码基因进行疾病关联分析,结果显示心血管相关疾病在 AMI 中显著富集,证实这些差异蛋白与 AMI 存在密切的病理关联性(图 5A)。
通过对比 AMI 组与健康对照组的蛋白表达水平,筛选出 4 种核心候选标志物,其中 F2(凝血酶原)和 OLR1(凝集素样氧化低密度脂蛋白受体 1)在 AMI 组高表达,F3(组织因子)和 APCS(血清淀粉样 P 成分)在 AMI 组表达异常下调,这 4 种蛋白均能有效区分 AMI 患者与健康对照者,具备作为 AMI 生物标志物的潜力(图 5B)。
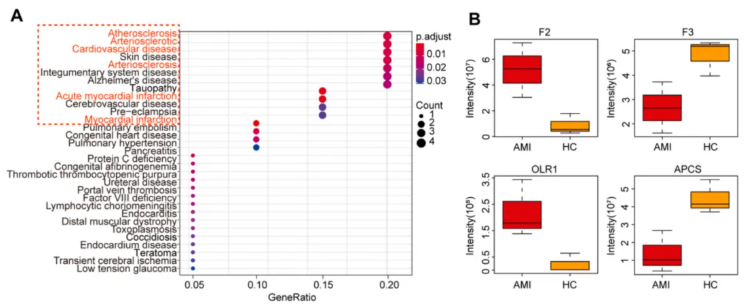
图5. 差异蛋白的疾病富集分析及潜在标志物表达对比
研究结论
本研究首次通过 EXODUS 系统成功分离并表征了 AMI 患者尿液外泌体,证实其在颗粒数量、标志性蛋白表达及蛋白质组学特征上与健康对照者存在显著差异,且这些差异可能反映了 AMI 的病理生理机制。
筛选出的 30 种差异蛋白中,F2、F3、OLR1 和 APCS 构成的蛋白质组合具有作为 AMI 无创生物标志物的潜力,其中 F2 和 OLR1 上调、F3 和 APCS 表达异常,与 AMI 的凝血激活、血管损伤等病理过程密切相关。
尿液外泌体作为无创、易获取的生物样本,其蛋白质组学分析为 AMI 的早期诊断提供了新的技术路径,有望弥补传统血清标志物的局限性,为临床转化提供了重要的生物学依据。
外泌体蛋白冠-DIA:借助纳米颗粒表面修饰的探针捕获体液中的外泌体,无需额外从样本中提取外泌体,仅需少量样本,可鉴定上千种外泌体蛋白,对 ExoCarta 数据库高覆盖,灵敏特异且流程标准化,助力生物标志物发现与精准医学研究。









