
文章标题:Small extracellular vesicles derived from adipose mesenchymal stem cells alleviate intestinal fibrosis by inhibiting the FAK/Akt signaling pathway via MFGE8
发表期刊:Journal of Gastroenterology
影响因子:6.9
客户单位:中山大学附属第六医院
百趣提供服务:Label free定量蛋白质组学
肠纤维化是克罗恩病(Crohn’s disease, CD)最常见和最严重的并发症之一,越来越多的研究表明,脂肪间充质干细胞衍生的小细胞外囊泡(adipose mesenchymal stem cell-derived small extracellular vesicles, AMSC-sEVs)可以缓解肾纤维化、肝纤维化等,但其治疗肠纤维化的潜力尚不确定。因此,本研究旨在确定AMSC-sEVs对肠纤维化的治疗作用,并确定这些作用的机制。
1.sEVs对AMSCs抗纤维化作用至关重要
为探究sEVs是否作为AMSC抑制肠道纤维化的旁分泌介质,收集了两种不同的培养基,即条件培养基(Conditioned medium, CM)和不含sEV的条件培养基(Conditioned medium without sEVs, RCM) (图1A),然后将它们分别与肌成纤维细胞共培养48小时。CM能降低TGF-β1刺激的成纤维细胞中胶原蛋白I表达,抑制肠道纤维化,而RCM可逆转此效果,表明AMSCs通过分泌sEVs发挥抗纤维化作用(图1B-C)。此外,蛋白质印迹结果显示,用AMSC-CM处理的小鼠的胶原蛋白I表达低于模型组,但RCM逆转了这一变化(图1G)。这些结果表明AMSC-sEVs可能在体外和体内减轻肠道纤维化。使用透射电子显微镜、纳米颗粒跟踪分析和蛋白质印迹法对AMSC-sEVs进行表征,发现AMSC-sEVs呈典型形态,粒径43-100nm,符合sEV鉴定标准。
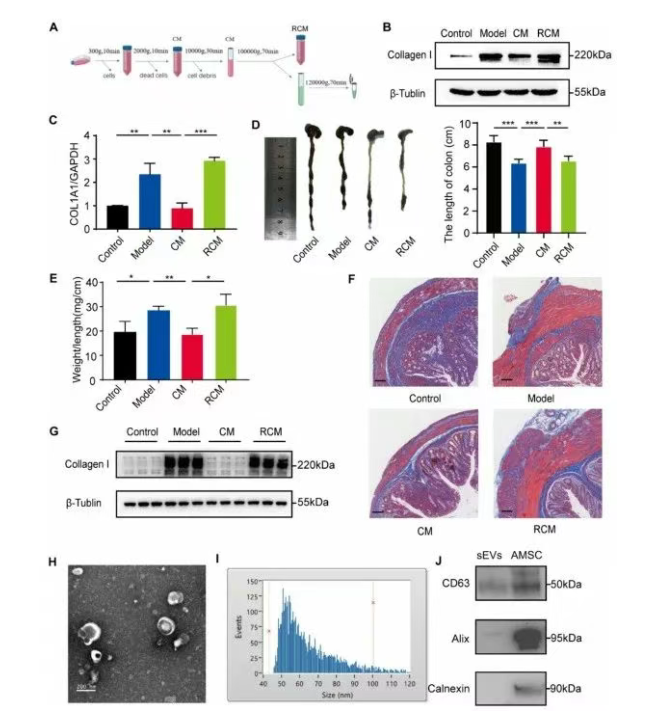
图1. AMSC-CM在体外和体内均能抑制肠纤维化
2.AMSC-sEVs抑制成纤维细胞活化
共聚焦图像显示AMSC-sEVs位于肌成纤维细胞的细胞质中,表明AMSC-sEVs可以被肌成纤维吞噬(图2A)。为了研究AMSC-sEVs对抑制肌成纤维细胞活化的影响,用TGF-β1刺激的人肠成纤维细胞(Human Intestinal Fibroblast, HIFs) 和CCD18co进行处理;与模型组相比,无论sEVs的浓度如何,AMSC-sEVs都能抑制胶原蛋白I的表达,浓度达到 20μg/ml时效果最明显(图2B-E)。因此,选择20μg/ml的AMSC-sEVs用于后续的体外实验。此外,AMSC-sEVs阻止了TGF-β1诱导的成纤维细胞向肌成纤维细胞的转化,随着这种转化的抑制,COL1A1和MMP2的表达降低(图2D-G)。
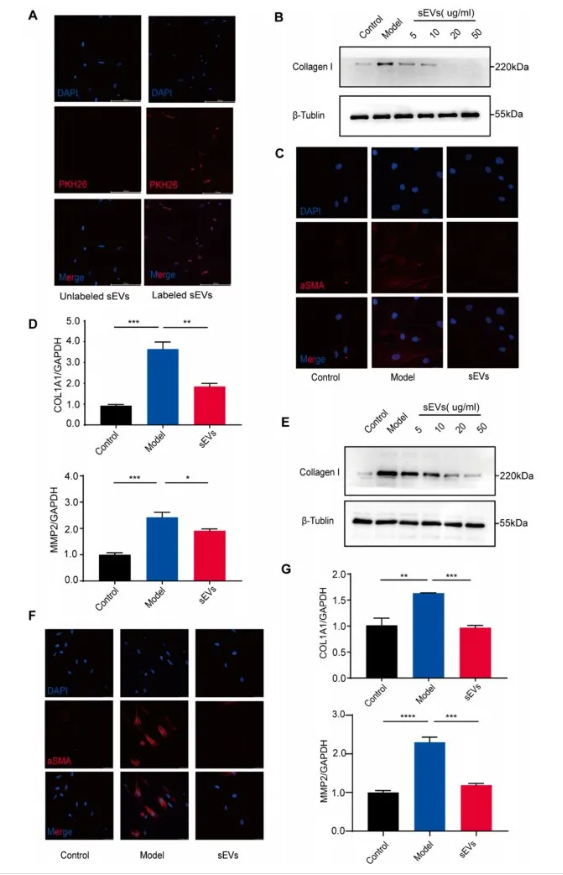
图2. AMSCs-sEVs消除了成纤维细胞向肌成纤维细胞的转变
3.AMSC-sEVs可逆转两种肠道纤维化模型中的纤维化
为追踪输注的AMSC-sEVs在体内的生物分布,将CM-DiR标记的AMSC-sEVs腹腔注射到2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)诱导的小鼠体内。在注射sEVs后24和48小时对小鼠进行体内荧光成像,并在小鼠处死后新鲜解剖并收集心脏、肝脏、脾脏、肺脏、肾脏和结肠用于后续测试,发现AMSC-sEVs主要分布在结肠(图3A)。
为了测试AMSC-sEVs的效力,我们将其(每只小鼠每天30μg,连续7天)应用于右旋糖酐钠盐(Dextran sodium salt, DSS)诱导的肠道纤维化小鼠模型中。在DSS模型中,AMSC-sEVs显著减轻了结肠缩短和重量/长度比,降低了纤维化评分(图3B-E)。通过蛋白质印迹法评估的胶原蛋白I水平以及通过RT-qPCR测量的纤维化指数(COL1A1和MMP2)在模型小鼠的结肠中在AMSC-sEV治疗后也显著降低(图3F-G)。
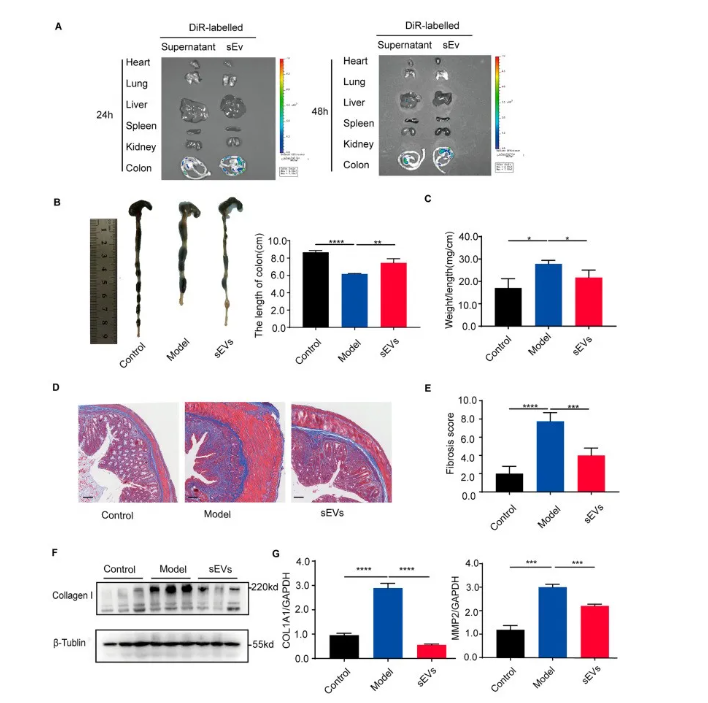
图3. 治疗性AMSC-sEVs应用改善了慢性DSS诱导模型中的肠纤维化
4.AMSC-sEVs的蛋白质组学分析
为鉴定AMSC-sEVs中的稳定蛋白质,使用SwissProt数据库在sEVs中鉴定出357种蛋白质,其中10种蛋白质的表达倍数变化在1.2或以下。我们关注抗纤维化相关蛋白质,并选择MFGE8、FBLN1和 Rac1进行进一步研究。此外,发现FAK和PI3K-Akt信号通路与AMSC-sEVs中蛋白质相关的信号通路最为密切相关。
5.MFGE8在体外和体内减少肠纤维化
如图4A所示,MFGE8以剂量依赖的方式有效降低了TGF-β1存在下HIFs中胶原蛋白I的水平。然后使用500 ng/ml MFGE8进行后续的体外实验,证明了MFGE8可以有效降低HIFs和CCD18co中纤维化生物标志物的表达。
此外,为了探索MFGE8在体内的作用,将MFGE8腹腔注射到实验性小鼠结肠纤维化模型中,发现MFGE8给药显著减轻了肠道纤维化,表现为结肠延长和结肠重量/长度比降低(图4C-D)。与模型组相比,MFGE8显著降低了小鼠结肠的内镜和纤维化评分(图4E-F);在另一种TNBS诱导的小鼠肠道纤维化模型中,观察到MFGE8的类似作用,进一步证实了MFGE8在减轻肠道纤维化中的作用。
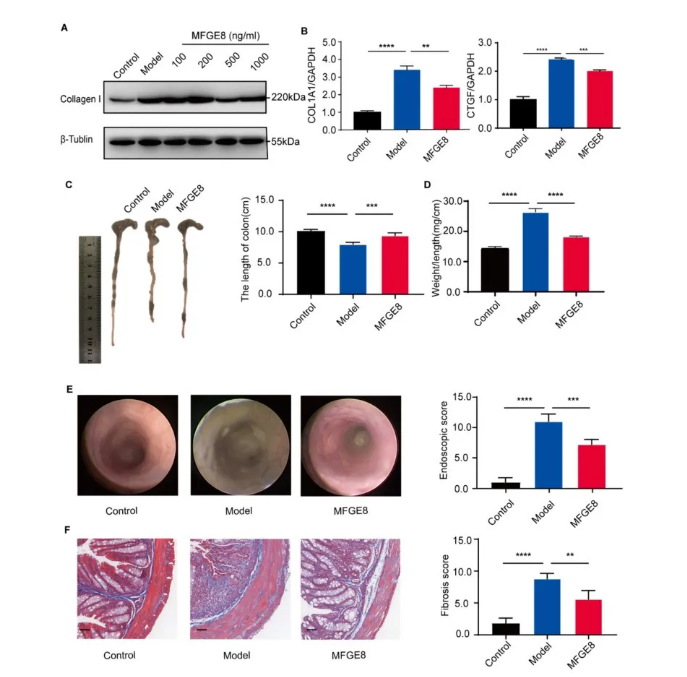
图4. MFGE8抑制DSS诱导的小鼠模型中成纤维细胞向肌成纤维细胞的分化,逆转终末期纤维化
6.MFGE8沉默的sEVs不能减轻肠道纤维化
为了进一步确定MFGE8是否参与AMSC-sEVs对肠道纤维化的影响,在AMSCs中敲除MFGE8。发现与AMSC-sEV siControl处理的细胞相比,胶原蛋白I蛋白产生增加(图5A-C),COL1A1和MMP2 mRNA表达增加(图5B-D)。此外,将AMSC-sEVssiMFGE8腹腔注射到DSS诱导的肠道纤维化小鼠模型中,发现与AMSC-sEV siControl相比,AMSC- sEVssiMFGE8的应用导致内镜评分和纤维化评分增加(图5F-G)。在TNBS诱导的肠道纤维化模型中重复了实验,得到了类似的结果,进一步证实了AMSC-sEVs通过MFGE8发挥抗肠道纤维化作用。
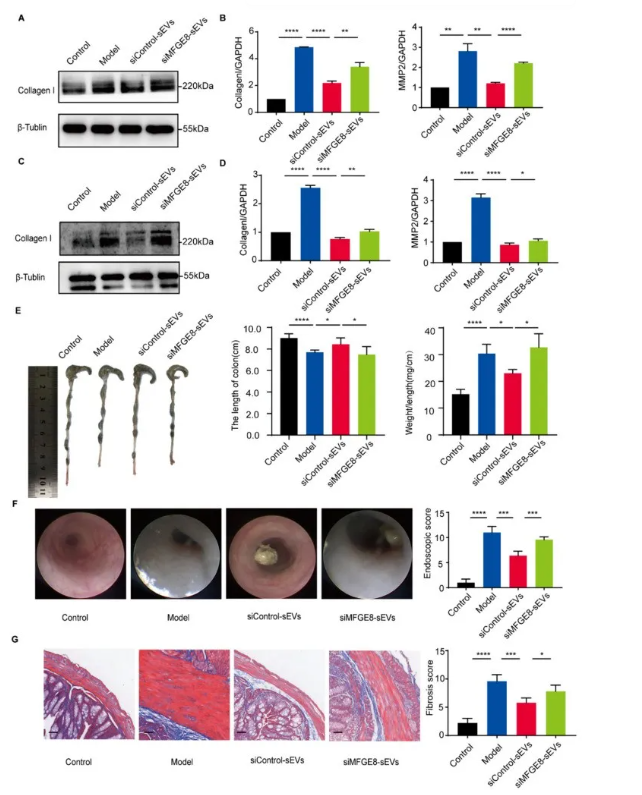
图5. AMSC-sEVs通过体内外递送MFGE8缓解肠纤维化
7.AMSC-sEVs转移的MFGE8通过抑制FAK/Akt信号通路减轻HIF的纤维化
KEGG通路分析揭示了sEV相关的FAK通路的改变,该通路参与了皮肤、肺和肾脏中的各种纤维化过程(图6A)。此外,对于HIFs,TGF-β1激活了FAK/Akt通路,增加了p-FAK和p-Akt的磷酸化。同样,在DSS诱导和TNBS诱导的肠道纤维化模型小鼠中证实了MFGE8沉默导致的FAK/Akt通路重新激活。因此,我们推测AMSC-sEV siControl通过抑制FAK/Akt信号通路来治疗肠道纤维化。
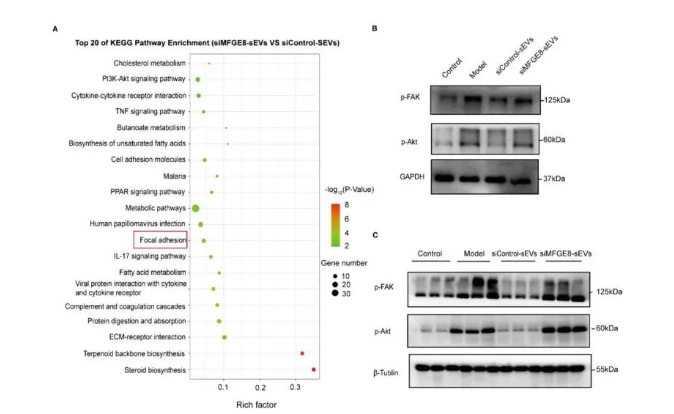
图6. AMSC-sEVs通过体内外递送MFGE8缓解肠纤维化
本研究验证了AMSC-sEVs在体内外可减轻肠纤维化,且可能通过MFGE8抑制FAK/Akt信号通路实现,为临床治疗长纤维化提供理论依据。
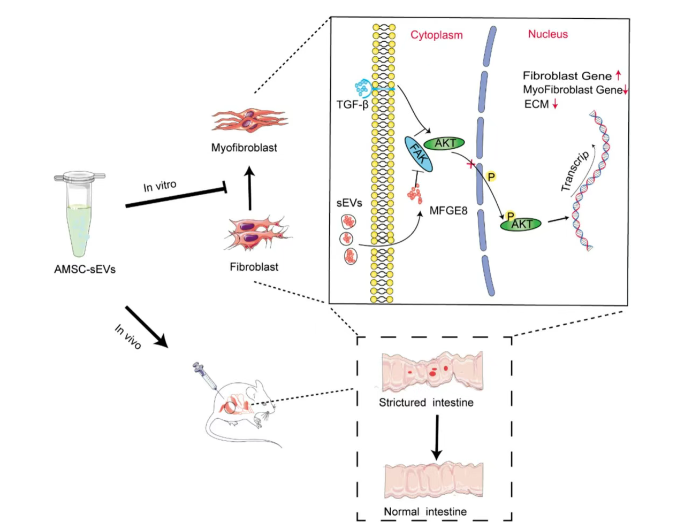
图7. AMSC-sEV抗肠纤维化的可能机制
-
 深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16
深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16 -
 薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13
薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13 -
 第37期代谢组学暨多元变量统计分析培训班由上海百趣生物医学科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“百趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13
第37期代谢组学暨多元变量统计分析培训班由上海百趣生物医学科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“百趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13 -
 新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05
新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05 -
 新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01
新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01 -
 项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01
项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01 -
 Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05
Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05 -
 百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22
百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22 -
 项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18
项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18 -
 百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21
百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21








