
文章标题:Single-cell transcriptomics reveals intestinal cell heterogeneity and identifies Ep300 as a potential therapeutic target in mice with acute liver failure
发表时间:2023年7月25日
发表期刊:Cell Discovery
影响因子:33.5
技术平台:单细胞转录组, 16S rRNA测序,qRT-PCR,ELISA
研究背景
急性肝衰竭(Acute liver failure, ALF)是一种死亡率高的严重肝功能障碍综合征,其主要治疗方法是支持治疗和肝移植,但这两种治疗都受到高成本和不确定效果的限制,且供体的稀缺严重限制了肝移植的应用,这凸显了对ALF的基础研究和寻找新的相关治疗靶点并进行药物开发以改善ALF治疗的必要性。
肠-肝轴是指肠道微生物群落与肝脏之间的相互作用关系,肠-肝轴在人体中起着至关重要的作用,控制着胃肠道和肝脏的健康。肠道粘膜具有巨大的表面积,作为对抗潜在病原体的免疫屏障起着至关重要的作用。肠道粘膜的功能是作为外来物质与存在于肠道和肝脏中的物质相互作用的场所,使营养物质进入循环并到达肝脏,同时限制微生物和毒素的全身传播。在本研究中,使用单细胞转录组测序技术(Single Cell RNA Sequencing, scRNA-seq)对D-半乳糖胺/脂多糖(D-galactosamine/lipopoly-saccharide, D/L)诱导的小鼠ALF模型的肠道细胞图谱进行了全面和比较的表型分析,确定并证实了Ep300是治疗ALF的有效靶点,并探讨了Ep300抑制的作用机制。
结果
在D/L诱导的ALF小鼠模型中,观察到肠绒毛破损,肠隐窝暴露,肠紧密连接破坏(图1 a)。从D/L诱导的ALF模型小鼠中收集肠上皮组织(The intestinal epithelium, IE)和潘氏斑(Peyer's patches, PPs)(图1 b),进行scRNA-seq分析。在质量控制之后,从12只小鼠中获得的33,216个高质量细胞(图1 c、 d)。无监督聚类将细胞划分为16个簇(C0至C15),使用t分布随机邻居嵌入(T-distributed stochastic neighbor embedding, tSNE)进行可视化(图1 e)。通过表达特征鉴定出11种主要细胞类型:B细胞、T细胞、巨噬细胞、中性粒细胞、肠细胞、干细胞、杯状细胞、肠内分泌细胞、潘氏细胞、簇状细胞和成纤维细胞。
关注免疫细胞的变化,发现两种组织中B细胞比例显著降低,而上皮组织中T细胞比例增加(图1 g、h)。在免疫细胞中,差异基因表达分析显示,与免疫调节、生物刺激和炎症性肠病(Inflammatory bowel disease, IBD)相关的基因显著上调(图1 i)。总之,免疫细胞和肠道上皮细胞的这些变化创造了ALF小鼠肠道的图谱,显示免疫系统失调和肠上皮屏障和微环境的破坏。
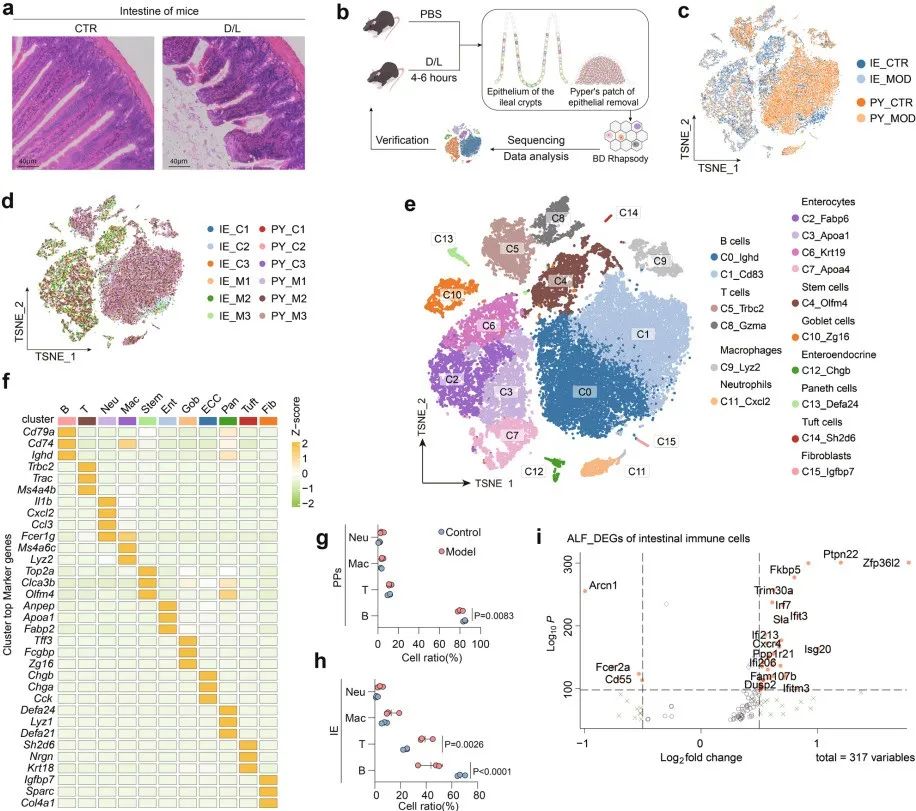
图1. D/L诱导的ALF小鼠肠道细胞异质性分析结果
为了进一步揭示ALF小鼠肠道免疫细胞的变化,作者分析了免疫细胞(包括T/NK细胞、B细胞和骨髓细胞)的异质性(图2 a)。使用无监督聚类将T/NK细胞分为7个簇(图2 b)。常见的T/NK细胞亚群是根据识别的标记基因的表达来鉴定的,如Cd4_Tn、Cd8_Tn 、Cd4_Treg/Th亚群和NK亚群(图2 b、c)。图2d所示,Cd3d+Gzmb+ T细胞仅存在于IE底部,而在PPs内未观察到该类细胞(图2d)。通过将T/NK细胞的前100个ALF差异基因映射到这些细胞簇中,进一步探索了T/NK细胞的活化作用,聚类热图显示,肠潘氏斑T细胞(Intestinal PP T cells, IP-T)和上皮内淋巴细胞(Intraepithelial lymphocytes, IEL)在ALF小鼠中具有不同的活化基因(图2 e)。IEL中ALF差异基因多于IP-T(n = 1028 vs n = 571, log2FC > 0.25),表明ALF对IEL的影响更大,这可能与IE中T细胞比例增加有关(图1 h)。基于无监督聚类、聚类差异基因以及GO分析,在小鼠肠道中定义了10个B细胞簇(n = 13,778)(图2 g)。为了对B细胞簇进行分类,比较了两种不同的干扰素簇(B4和B9)的激活特性,结果显示B6-B10高表达Nr4a1和Junb(图2 h)。总之,研究数据表明,在ALF小鼠中,肠道免疫细胞,包括T/NK细胞、B细胞和骨髓细胞,被迅速激活。
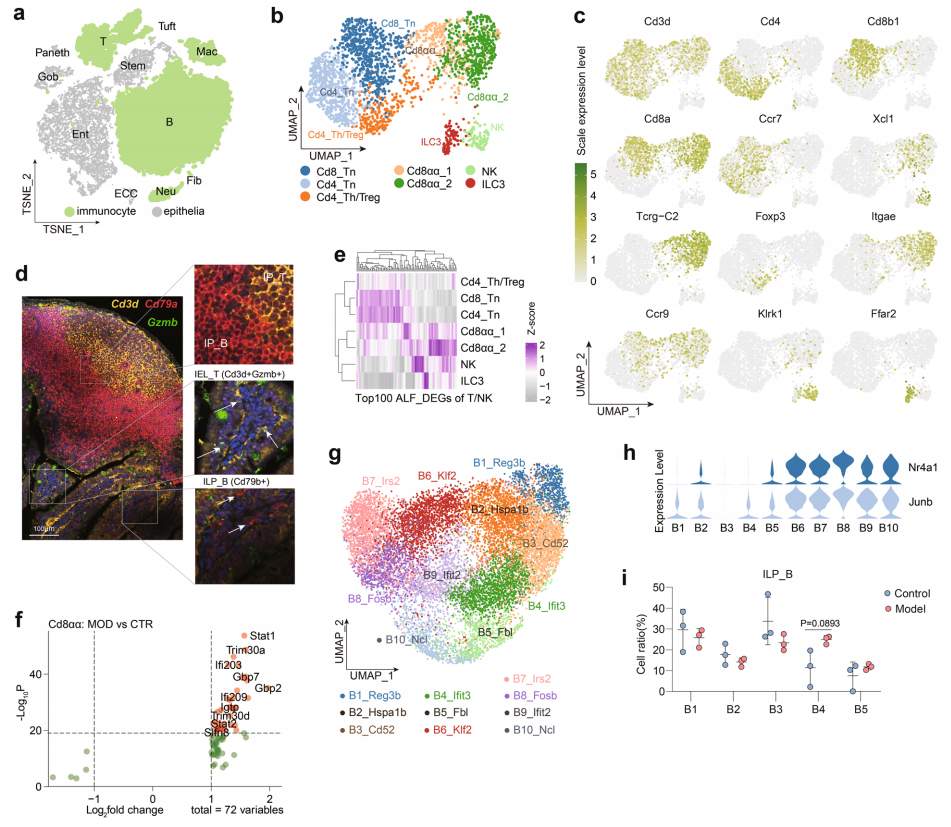
图2. ALF诱导肠道免疫细胞活化分析
为了揭示D/L诱导ALF小鼠肠道微生物的变化以及Ep300i的潜在调控作用,作者收集了小鼠回肠内容物并进行了16S rRNA分析。α多样性分析表明Ep300i能显著改变ALF小鼠的肠道微生物群(图3 a、b)。在D/L组中,Algoriphagus、Alloprevotella、[Eubacterium] _coprostanoligen_group、NS9_marine_group和Akkermansia五个属的相对丰度增加,但被Ep300i处理抑制(图3 c)。此外,上述5种微生物与谷丙转氨酶(Alanine aminotransferase, ALT)和谷草转氨酶(Aspartate aminotransferase, AST)水平呈正相关,Algoriphagus和NS9-marine-group与血清肠道脂肪酸结合蛋白(Intestinal fatty-acid binding protein, iFABP)和LPS水平呈正相关(图3 d)。线性判别分析效应大小(Linear discriminant analysis effect size, LEfSe)分析也支持上述五种微生物可以作为ALF小鼠肠道变化的生物标志物的观点(图3 e)。作者基于PICRUSt2预测了不同实验组微生物基因的KEGG通路,发现在ALF小鼠中,与能量代谢、细胞死亡、转运和病毒感染相关的通路上调,但这些通路的上调被Ep300i抑制(图3 f)。令人惊讶的是,与scRNA-seq结果一致,能量代谢异常、微生物感染和细胞死亡是ALF影响的IEC的主要变化,这表明肠道微生物组的变化与IEC损伤之间存在很强的相关性。
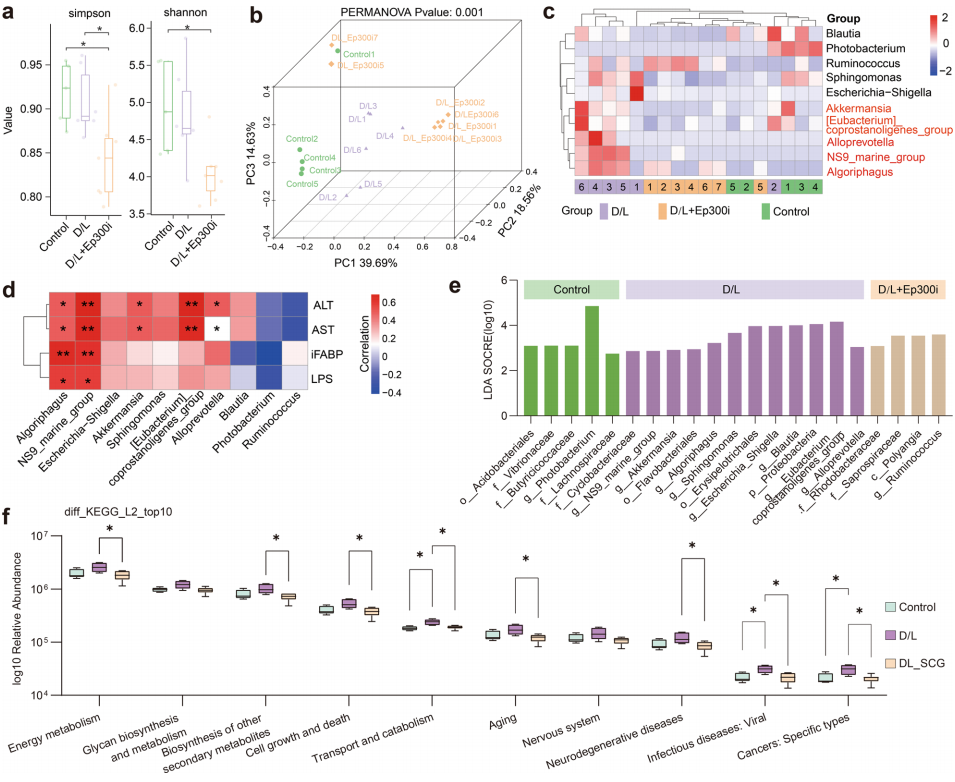
图3. 抑制Ep300调控肠道微生物稳态
综合分析了SCENIC数据库(https://scenic.aertslab.org/)中的Ep300靶基因和所有细胞中上调幅度最大的差异基因后,鉴定出了D/L小鼠肠道中上调幅度最大的6个靶基因(Celsr3、Gins3、Sh3bp5、Anxa9、 Plekhm1、Ptprb)。这些Ep300靶基因与肠细胞自噬、凋亡、微生物感染和癌变密切相关,可作为ALF肠损伤中Ep300激活的标志物。接着对这些基因做了qRT-PCR验证,结果表明,D/ L诱导的小鼠肠道内Ep300的激活伴随着这些靶基因的上调,Ep300i显著抑制了这些靶基因的表达(图4 a)。为了进一步证实Ep300激活在ALF中的普遍性,建立了对乙酰氨基酚(APAP)或硫代乙酰胺(TAA)诱导的ALF模型并进行了相关验证。如图4b所示,APAP和TAA诱导小鼠模型的肠绒毛空泡化明显增加,并伴有绒毛破坏和紊乱。结果显示,单细胞转录组学中D/L诱导的ALF小鼠肠道差异基因(图4 c、 d)和Ep300靶基因(图4 e、f)在APAP或TAA诱导的ALF小鼠肠道中均显著上调。此外,APAP或TAA诱导的ALF小鼠肠道中Saa1+Apoa1+肠细胞和Ido1+Muc2+杯状细胞的数量(图4 g、h)以及JNK的P38磷酸化(图4 i)修饰水平显著增加。这些数据证实Ep300是保护ALF小鼠肠道,缓解ALF的治疗靶点。通过分析极具代表性的D/L诱导的ALF模型得到的结果,推测Ep300i通过P38-JNK通路抑制肠上皮细胞(Intestinal epithelial cells, IECs)失调集群的炎症和氧化应激,并调节肠道微生物组成和代谢,纠正肠道生态失调,从而保护IECs,减轻ALF(图5)。
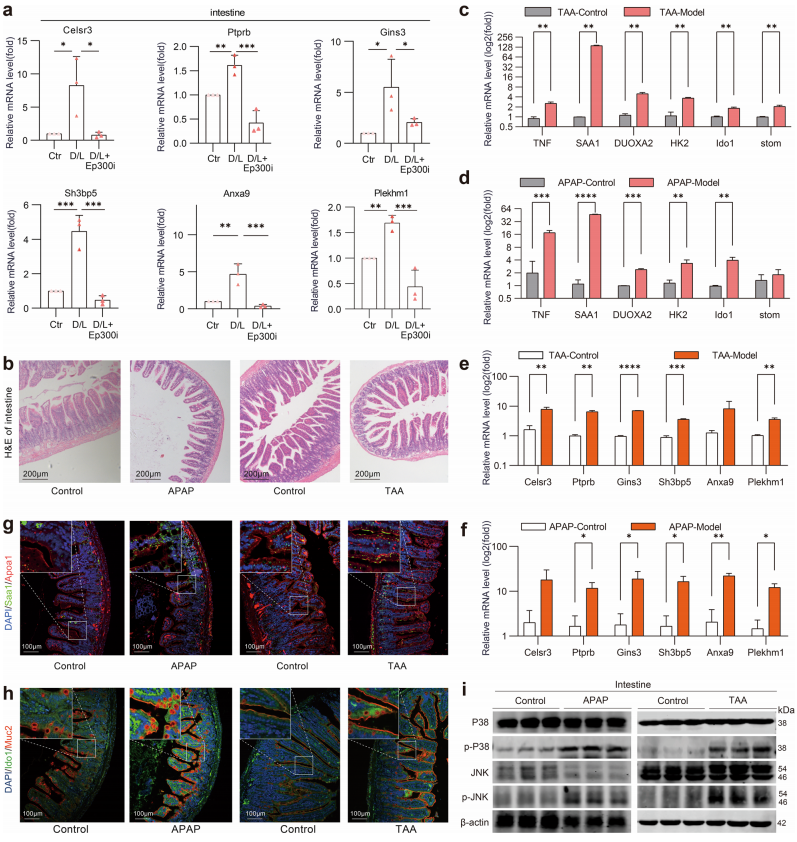
图4. Ep300依赖性转录调控在不同的小鼠ALF模型中的通用性
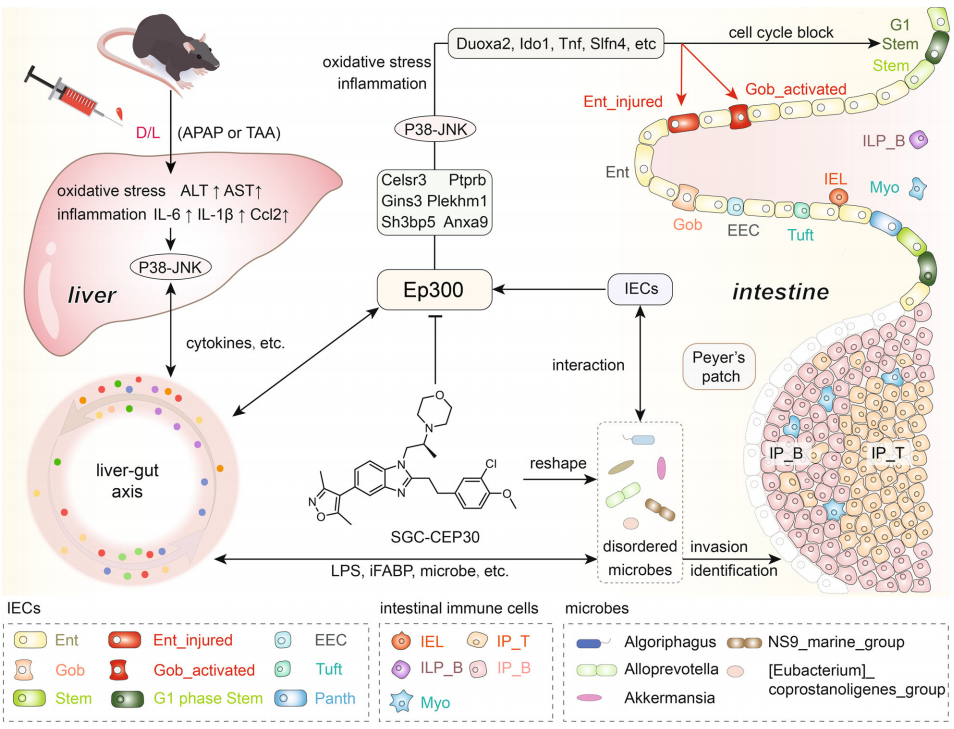
图5. ALF小鼠肠细胞异质性及Ep300i作用机制示意图
结论
本研究利用D/L诱导的ALF小鼠,表征33216个单细胞转录组,定义小鼠ALF肠道细胞图谱;并确定了ALF期间这些亚群的转录谱,描述了IECs的异质性,发现ALF诱导肠干细胞的细胞周期阻滞,并激活特异性肠细胞和杯状细胞簇;同时也揭示了一个共同EP300依赖性转录程序,证实Ep300是缓解ALF的有效靶点,进一步的机制研究发现Ep300抑制通过P38-JNK通路抑制IECs失调簇的炎症和氧化应激,调节肠道微生物组成和代谢来纠正肠道生态,从而保护IECs,减弱ALF。这些发现证实了Ep300是ALF的一个新的治疗靶点,为未来ALF的病理生理研究铺平了道路。
-
 深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16
深化合作 | SCIEX全球副总裁蔡俊松一行来访百趣,共探合作新方向近日,SCIEX全球副总裁、中国区总经理蔡俊松先生与中国市场副总监江峥女士莅临上海百趣生物医学科技有限公司(以下简称“百趣生物”)苏州产能中心。此次访问,蔡俊松先生、江峥女士与百趣生物总裁邓军亮先生及市场中心总监程羿淳女士进行了深入的交流。2024-04-16 -
 薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13
薅羊毛 | 组学推荐,豪礼送不停时光荏苒,百趣生物已经迎来了第12个生日!我们始终坚守初心,致力于质谱技术在动植物生命科学和医学健康领域的研究与创新。在这个值得纪念的日子里,我们特别策划了一场“推荐有礼”活动,邀请广大科研小伙伴们共同参与,推荐您身边有组学需求的伙伴,成功签单,即可获得丰厚礼品!2024-03-13 -
 第37期代谢组学暨多元变量统计分析培训班由上海百趣生物医学科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“百趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13
第37期代谢组学暨多元变量统计分析培训班由上海百趣生物医学科技有限公司、Sartorius Stedim Data Analytics AB(简称Sartorius Stedim)联合主办,上海百趣代谢组学技术研究中心承办的“百趣课堂第37期代谢组学暨多元变量统计分析培训”课程将于2024年04月20日-25日在上海举办。2024-03-13 -
 新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05
新品发布 | 全面聚焦,探索一碳代谢新可能一碳代谢通路检测能精准定量生物体叶酸、四氢叶酸等代谢物浓度,为推动妇幼相关疾病研究及LDT转化提供新视角和新可能~2024-03-05 -
 新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01
新品发布 | 直达CNS, 植需NGM尽管植物代谢组学数据的复杂,但为了解决“多”和“准”的核心需求,小趣特为植物领域工作者推出开工BUFF--植物NGM系列产品。2024-03-01 -
 项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01
项目文章(IF=27.5) | RIN基因新发现:通过根际分泌物塑造抑菌微生态,提升植物免疫力本研究发现植物发育基因可以通过对植物根系分泌物和微生物组组装的影响来控制微生物组介导的抗病性,从而使植物能够利用微生物组编码的基因和功能。2024-03-01 -
 Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05
Cell | CUHK于君团队最新研究成果,除了幽门螺旋杆菌,还有你不知道的胃癌致病因子?胃癌(Gastric cancer, GC)是全球第五大常见癌症,也是导致癌症死亡的主要原因。幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的主要危险因素,被列为I型致癌物。2024-02-05 -
 百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22
百趣生物院士专家工作站——邓春晖教授签约仪式顺利举行2024年1月18日,上海百趣生物院士专家工作站一邓春晖教授签约仪式在上海百趣生物医学科技有限公司(以下简称百趣生物)总部顺利举行。复旦大学邓春晖教授、百趣生物CEO邓军亮等出席签约仪式。2024-01-22 -
 项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18
项目文章 | 蛋白质组学:看蚕豆-小麦间作系统如何击败尖孢镰刀菌与苯甲酸的威胁蚕豆(Vicia faba L.)是中国西南地区最重要的豆科作物之一。但长期单作,会导致蚕豆枯萎病发病率升高,产量和品质下降。已有研究表明,蚕豆与小麦间作可有效缓解蚕豆的自毒作用,抑制蚕豆枯萎病的发生。2024-01-18 -
 百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21
百趣助力乳腺癌亚型新解析,开启乳腺癌治疗新篇章!百趣提供技术服务:非靶标代谢组+脂质组学2023-11-21








