

英文标题:Single cell transcriptional analysis of human adenoids identifies molecular features of airway microfold cells
中文标题:人腺样体单细胞转录组分析揭示呼吸道微皱褶细胞的分析特征
发表期刊:Mucosal Immunology
影响因子:7.6
文章背景
呼吸道作为病原体(如结核分枝杆菌、SARS-CoV-2、流感病毒等)入侵人体的首要门户,其黏膜免疫防御系统是抵御感染的关键屏障。人腺样体作为上呼吸道黏膜相关淋巴组织(MALT)的核心组成部分,长期被认为在局部免疫应答中发挥重要作用,但由于传统研究技术的局限,其内部细胞群体的具体分类、功能特征及互作机制尚未被完全解析——尤其是对黏膜免疫启动至关重要的微皱褶细胞(M细胞),其在人腺样体中的发育起源、分子标识及抗原转运调控机制仍存在诸多未知。同时,此前研究也未明确人腺样体中是否存在能快速感知病原体、启动早期免疫反应的特殊细胞类型,这极大限制了对呼吸道感染防御机制的深入理解,也为相关黏膜疫苗研发和抗感染治疗靶点筛选带来阻碍。在此背景下,借助单细胞转录组测序(snRNA-seq)等高精度技术,系统解析人腺样体的细胞组成与分子特征,挖掘关键免疫细胞(如M细胞)的功能机制,成为填补呼吸道黏膜免疫研究空白、推动抗感染领域发展的迫切需求。
技术路线
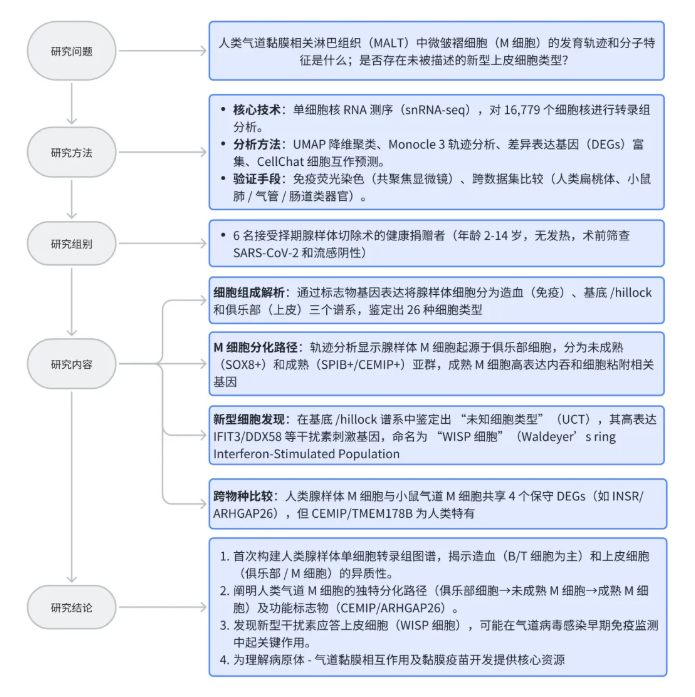
研究结果
1、人腺样体的细胞组成与谱系界定
为解析上呼吸道黏膜相关淋巴组织的细胞组成,研究人员收集6名接受选择性腺样体切除术捐赠者的临床腺样体组织,通过单细胞核RNA测序(snRNA-seq)分析16,779个细胞核(图1A)。经UMAP降维后,通过手动核对各细胞核群体的细胞类型基因表达标志物,鉴定出3种细胞核谱系(图1B):
1、造血细胞谱系:因高表达蛋白酪氨酸磷酸酶受体C(PTPRC,即CD45)、分化簇38(CD38)和信号淋巴细胞激活分子家族成员1(SLAMF1)被明确界定,该谱系共包含11,514个细胞核;
2、基底/丘状谱系:该谱系表达胰岛素样生长因子结合蛋白3(IGFBP3)、角蛋白8(KRT8)、蛋白酶体26S亚基非ATP酶5(PSMD5)等基底祖细胞、丘状细胞及神经内分泌细胞标记,共包含2,796个细胞核;
3、杯状细胞谱系:表达钙黏蛋白相关家族成员3(CDHR3)、叉头框J1(FOXJ1)、黏蛋白5B(MUC5B)等纤毛细胞、杯状细胞及微皱褶细胞(M细胞)标记(如肿瘤坏死因子受体超家族成员 11a,TNFRSF11A),共包含2,469个细胞核;
且基底/丘状谱系与杯状细胞谱系均不表达免疫细胞相关标记及差异表达基因(DEGs)(图1C)。
与此同时,模块分数分析表明:造血谱系细胞核表达B细胞标记CD19、T细胞受体ζ链CD247、树突状细胞标记ITGAX(CD11c)等免疫细胞标记;基底/丘状谱系表达IGFBP3、XVII型胶原α1链(COL17A1)、KRT8等相关基因;杯状细胞谱系表达分泌珠蛋白 1A1(SCGB1A1)、CDHR3、MUC5AC/5B及 TNFRSF11A(图1D-F)。
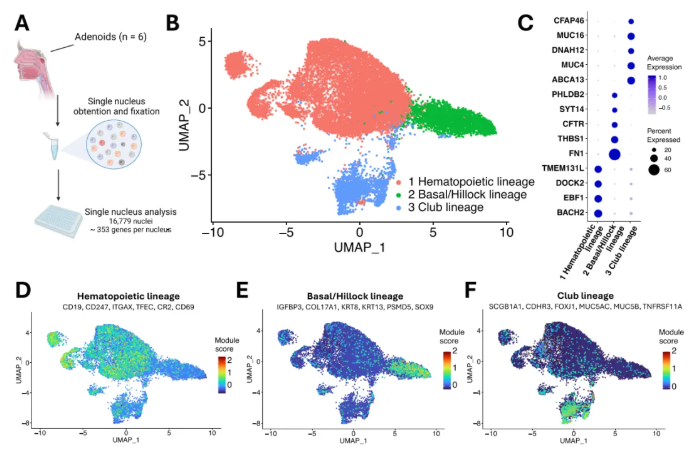
图1. 人腺样体的细胞组成
2、造血谱系细胞的表征
在确定造血谱系簇后,研究人员利用UMAP降维进行细胞亚群分析,共鉴定出15种免疫相关细胞类型(图2A)。与此同时,比例分析显示,造血谱系中B细胞、T细胞及巨噬细胞比例与先前研究一致,NK细胞略高,滤泡树突状细胞等因稀缺性与其他次级淋巴组织相符。值得注意的是,滤泡树突状细胞的转录特征含造血谱系标记(图2B)。
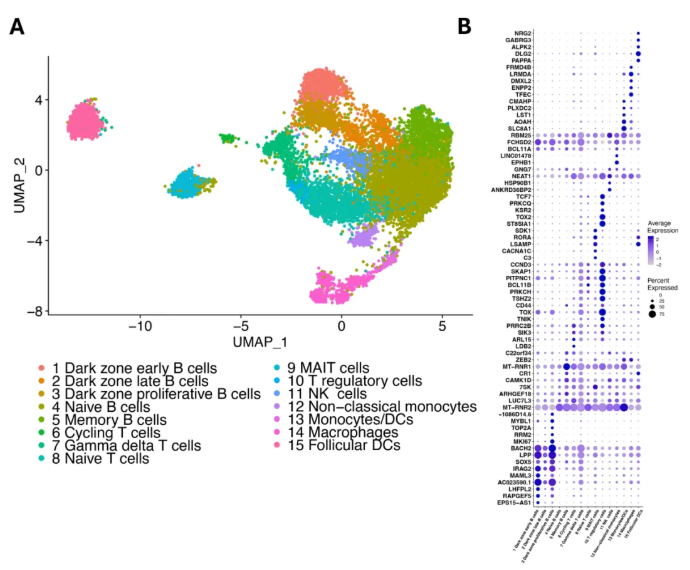
图2. 造血谱系细胞的特征
3、基底/丘状谱系细胞群体的表征
研究人员对基底/丘状谱系进行亚群分析,分别鉴定出基底细胞祖细胞、神经内分泌细胞、簇细胞、丘状细胞及未知细胞类型(UCT)(图3A)。5个细胞亚群差异表达基因(DEGs)显示,UCT除基底细胞DEGs外,还高表达干扰素刺激基因(ISGs),具有独特转录特征(图3B)。
拟时序分析显示:基底来源细胞聚集,丘状细胞独立成簇,是两条不同分化路径(图3C),且丘状细胞起源显著早于其他细胞簇,而基底相关簇呈现的中位拟时序值相近,反映其共同源自基底细胞(图3D)。不同细胞亚群的代表性DEGs拟时序分析,再次印证了基底来源细胞与丘状细胞不同起源;以及基底相关簇细胞的DEGs表达模式可能与丘状细胞不同(图3E)。这些结果阐述了人腺样体中基底细胞、其后代及丘状细胞的转录特征,并首次发现具有独特转录特征的UCT。
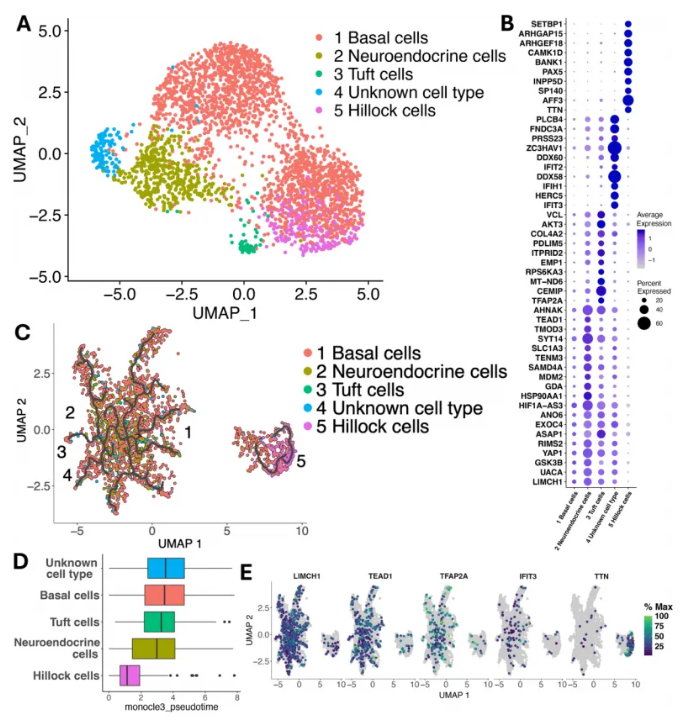
图3. 基底/丘状谱系细胞群的特征
4、“未知细胞类型”(UCT)是具有独特干扰素相关基因特征的基底细胞后代
研究人员对UCT进行探究,结果显示,UCT的显著DEGs的表达水平与其他基底/丘状谱系细胞差异显著,且在人腺样体所有细胞核群体中独特表达(图 4A);而新鉴定的UCT特异性DEGs与仅基于基底/丘状谱系分析的结果高度重叠,显著DEGs几乎一致(图4B)。进一步分析发现UCT的DEGs富集于三类生物学过程:细胞信号传导、感染反应、迁移与分化。细胞间通讯进一步发现,UCT与神经内分泌细胞、γ-δ T细胞、T调节细胞等存在强相互作用,其中与神经内分泌细胞的相互作用最强(图4C),主要通过PTPRM通路和THBS1-SDC4通路实现(图4D)。
此外人腭扁桃体单细胞图谱中标记为“VEGFA+细胞”的群体也表达UCT的DEGs(图4E)。免疫荧光验证显示,IFIT3、IFIH1、DDX58在人腺样体上皮细胞中共定位,且在4名独立捐赠者中均存在(图5A)。验证细胞间互作发现,UCT与FYN阳性细胞接近,且与仅表达CFTR的基底衍生细胞相邻(图5B-D)。
综上表明,UCT是基底细胞谱系中具有独特干扰素相关基因特征的细胞类型,参与感染反应相关过程,并与其他细胞存在特异性相互作用。
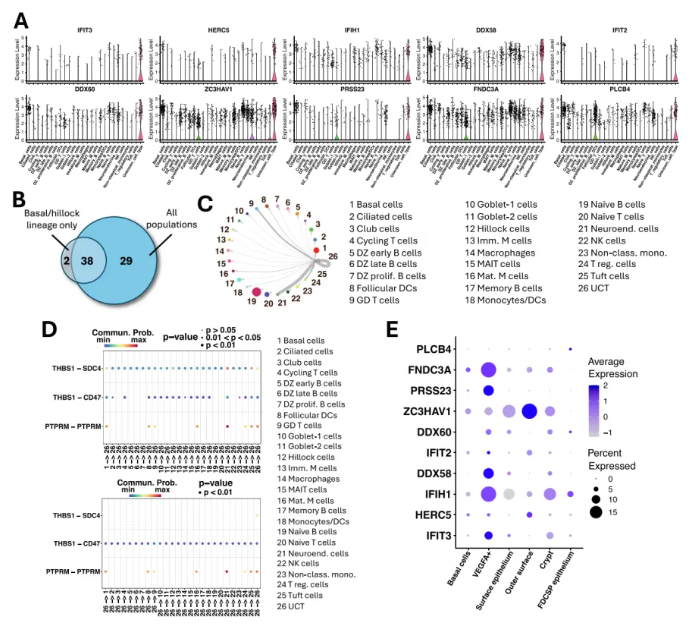
图4. “未知细胞类型”是基底细胞的后代,具有独特的干扰素相关基因特征
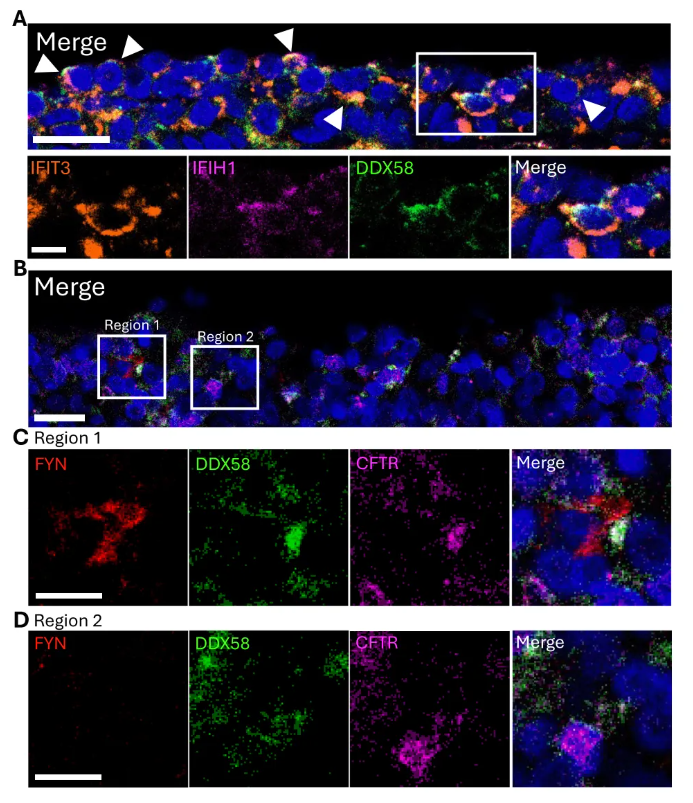
图5. “未知细胞类型”的top差异表达基因和细胞间相互作用的验证
5、杯状细胞谱系细胞群体的表征
研究人员对杯状相关细胞谱系进行亚群再分析,并标记出独特细胞核群体(图6A)。与此同时,杯状细胞谱系中的分泌型杯状细胞分为两型:杯状细胞-1表达MUC5AC/5B,杯状细胞-2表达MUC4、IL19等,两者共享BPIFB1、PIGR等黏液相关DEGs但表达水平不同(图6B)。而M细胞分为未成熟和成熟两群,未成熟M细胞DEGs平均表达低于成熟型,与小鼠胃肠道M细胞分化中过渡群体的描述一致(图6B)。
Monocle 3轨迹分析发现:杯状细胞主要位于中心,纤毛细胞富集于左侧,M细胞在右侧,两群杯状细胞在中央重叠(图6C)。拟时序分析显示,杯状细胞为最早出现的细胞,随后是两群杯状细胞和未成熟M细胞,成熟M细胞和纤毛细胞中位伪时间值较大(图6D)。 显著DEGs表达模式显示:杯状细胞的SNX29在轨迹中央细胞中高表达;纤毛细胞的CDHR3在轨迹左侧表达增加;杯状细胞的MUC5B/MUC4在轨迹两分支重叠表达;未成熟M细胞的SOX5在对应轨迹区域表达;成熟M细胞的CEMIP在轨迹右侧末端高表达(图6E)。研究者进一步提出了细胞分化模型:杯状细胞祖细胞先分化为未成熟M细胞和杯状细胞,未成熟M细胞进一步分化为成熟M细胞,纤毛细胞经较长时间直接源自杯状细胞;杯状细胞-1为向杯状细胞-2过渡的中间群体(图6F)。 这些结果阐述了杯状相关谱系及其分化路径。
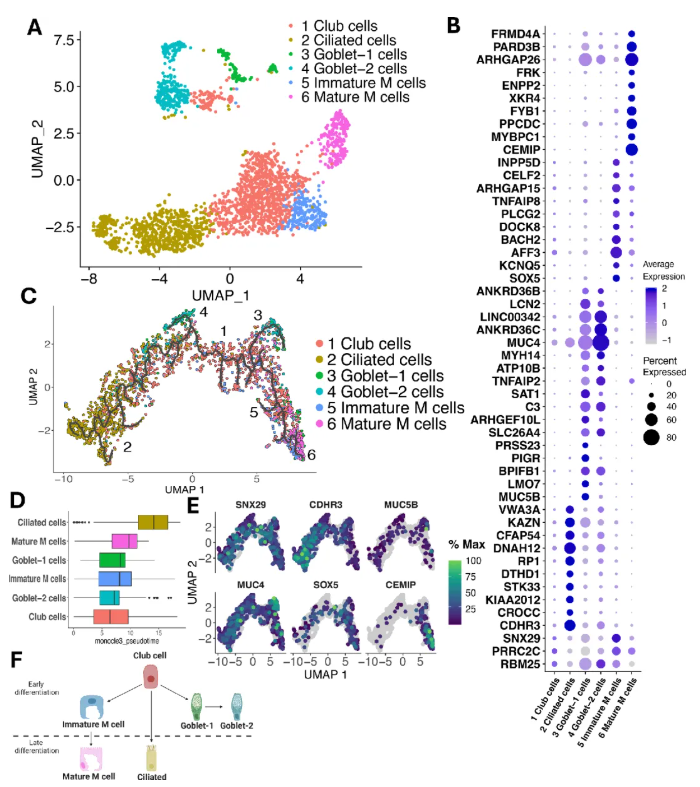
图6. 杯状细胞群的特征
6、人腺样体M细胞的表征
研究人员进一步参考人胃肠道、类器官及小鼠肺M细胞的潜在标记物,对M细胞进行分析(图7A)。结果显示,成熟M细胞高表达SPIB、TNFRSF11A及TNFAIP2,而GP2、CCL20及TNFRSF11B表达极低或未检测到(图7A)。
成熟M细胞的DEGs分析发现,杯状细胞谱系分析与全细胞分析的DEGs大部分重叠,仅少数基因特有。全细胞分析的显著DEGs包括CEMIP、MYBPC1等与黏膜免疫相关的基因(图7B)。通路分析显示,成熟M细胞富集细胞黏附、信号传导及运输相关通路,与M细胞的转胞吞功能一致。细胞通讯分析表明,未成熟M细胞与暗区B细胞、记忆B细胞等相互作用最强;成熟M细胞则与基底细胞、UCT等作用显著(图7C)。未成熟M细胞主要通过PTPRC-CD22通路与免疫细胞作用,成熟M细胞主要依赖PTPRM-PTPRM通路(图7D)。
免疫荧光实验表明,CEMIP与M细胞标记NKM 16-2-4、TNFAIP2共定位(图8A)。成熟M细胞与UCT及基底衍生细胞在接触点附近有PTPRM表达(图8B);未成熟M细胞(CDH18阳性)与暗区增殖性B细胞(MAST2阳性)、FYN阳性细胞通过CD22在接触部位相互作用(图8C-E)。这些结果表征了人腺样体中未成熟和成熟两群M细胞的分子特征、功能通路及与其他细胞的相互作用。
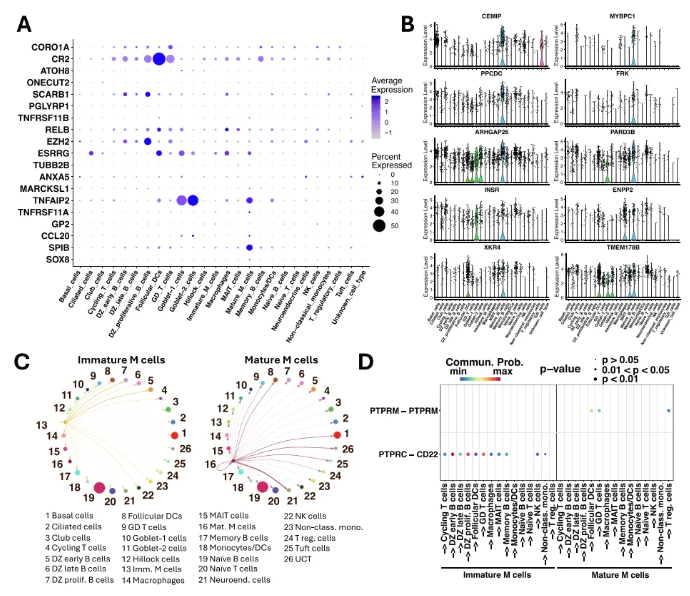
图7. 人腺样体M细胞的特征
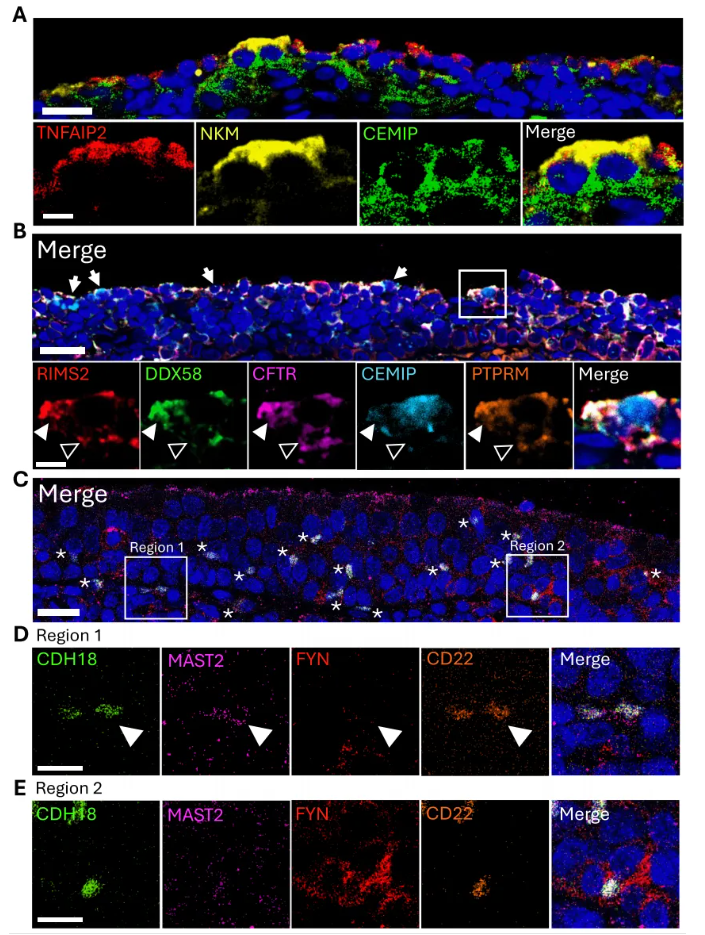
图8. 腺样体M细胞top差异表达基因及细胞间相互作用的验证
7、人腺样体M细胞差异表达基因的比较分析
研究人员将M细胞的DEGs与先前的气道和胃肠道细胞图谱研究进行比较。结果发现,未成熟M细胞的DEGs中,仅DOCK8、PLGC2、TNFAIP8在几乎所有人扁桃体上皮细胞中显著表达(图9A)。与此同时,相比小鼠肺和气管M细胞图谱,人成熟M细胞的CEMIP、MYBPC1等DEGs几乎低表达或不表达;而未成熟M细胞DEGs在小鼠图谱中无一致模式(图9B-C)。
进一步与经RANKL处理的小鼠肠道类器官M细胞比较显示,该体外诱导的M细胞群体显著表达上述4个成熟M细胞DEGs,且表达人腺样体未成熟M细胞标记物DOCK8、PLGC2、TNFAIP8(图9D)。这些结果表明,人腺样体M细胞存在独特表达的基因,凸显空间定位对M细胞转录组的影响。
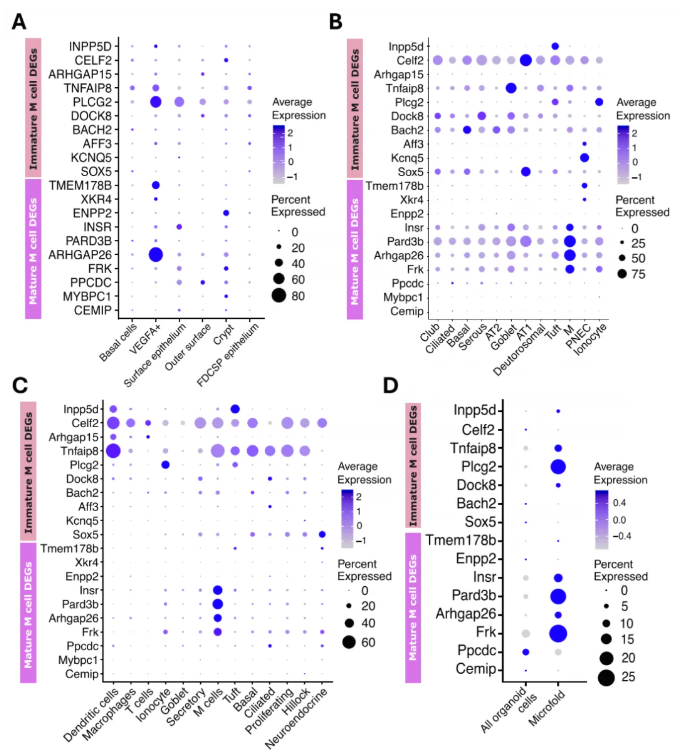
图9. 人类腺样体M细胞差异表达基因的比较分析
研究结论
本研究通过单细胞核RNA测序(snRNA-seq),对6名健康供体的人腺样体组织进行分析,构建出含26种独特细胞类型的图谱,涵盖造血、基底/丘状、杯状细胞三大谱系。研究明确人气道M细胞源于杯状细胞祖细胞,分未成熟与成熟两群,成熟M细胞高表达SPIB等基因且富集与转胞吞功能相关的通路;还在基底/丘状谱系发现高表达干扰素刺激基因的未知细胞类型UCT,并厘清杯状细胞谱系分化路径。结合轨迹分析、细胞通讯预测及免疫荧光验证,研究为理解气道黏膜免疫、病原体早期相互作用及黏膜疫苗研发提供重要依据。
单细胞转录组测序:是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。
空间转录组测序:通过对样本包埋切片并与检测芯片结合,利用序列标签(spatial barcode和UMI)区别不同细胞的空间位置,可高效检测组织中空间原始位置上的基因表达模式,两者联合可同时获取细胞类型、功能及空间定位信息。









