

文章标题:Bushen Huoxue recipe ameliorates ovarian function via promoting BMSCs proliferation and homing to ovaries in POI mice
发表期刊:Phytomedicine
影响因子:8.3
合作单位:华中科技大学同济医学院附属同济医院
合作产品:DIA中药入血组
研究背景
卵巢功能不全(Premature ovarian insufficiency, POI),又称卵巢早衰,是指女性在40岁之前卵巢功能丧失。POI可能导致不孕症、泌尿生殖器萎缩和骨质疏松症,以及心血管疾病和神经退行性疾病的风险增加。根据中医(TCM)理论,POI的症状包括月经不调、月经减少、闭经和不孕不育,POI的病因与肾虚血瘀有关。因此,补肾活血疗法被广泛用于改善POI。然而,补肾活血方(BHR)在POI治疗中的潜在机制尚未阐明。骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)是一种多能干细胞,因其在改善POI妇女卵巢功能和恢复生育能力方面的重要作用而受到越来越多的关注。
研究结果
1、BHR化学成分分析
采用UHPLC-MS/MS对BHR样品进行化学成分鉴定。BHR负离子和正离子模式下的总离子色谱图如图1所示。BHR共检出944种化学成分,主要为萜类、黄酮类、酚类、生物碱、芳香性物质、苯丙素、脂肪酰基、木脂素、环烯醚萜类和醌。
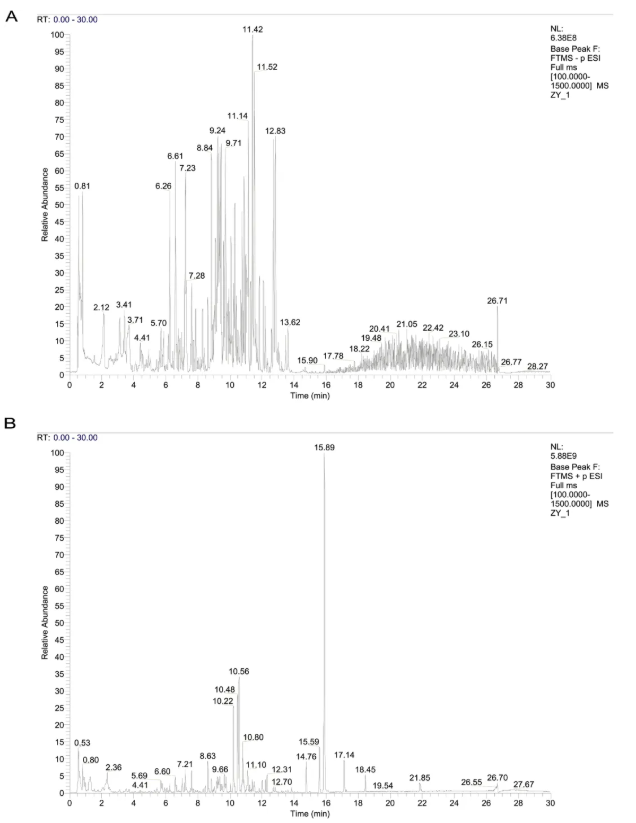
图1. LC-MS/MS分析BHR样品的离子色谱图
2、BHR可改善POI小鼠的体重减轻和卵巢指数降低,调节发情周期紊乱
实验方案如图2A所示。实验开始前,各组小鼠体重没有明显变化(图2C)。腹腔注射CTX两天后,除对照组外,其余各组小鼠体重均显著下降,其中模型组下降最为明显。建模后,模型组小鼠的生长速度减慢(图2B)。到D28时,与对照组相比,模型组的体重和卵巢指数均显著降低。与模型组相比,HBHR或DHEA治疗可显著改善小鼠体重和卵巢指数,而LBHR治疗仅导致卵巢指数显著升高(图2C-E)。同时,与对照组相比,模型组卵巢体积减小,而BHR组卵巢体积与对照组相当(图2H)。模型组小鼠发情周期明显紊乱,经BHR或DHEA处理后恢复(图2F-G和2I-N)。这些结果表明,BHR和DHEA治疗可有效改善卵巢指数下降和发情周期功能障碍。
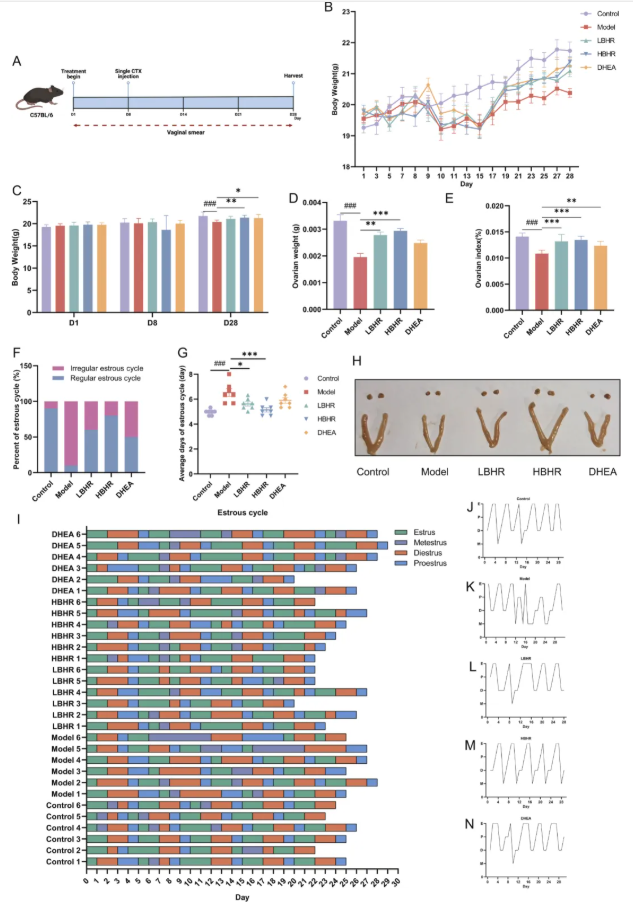
图2.BHR改善POI小鼠的发情周期、卵巢指数和体重
3、BHR改善POI小鼠的激素紊乱
在发情期采集血液样本。与对照组、模型组相比,小鼠FSH、LH水平显著升高,血清E2、AMH浓度显著降低。与模型组比较,HBHR组和DHEA组FSH和LH水平显著降低,E2和AMH水平显著升高。此外,LBHR治疗可改善FSH、LH和E2水平(图3A-D)。上述数据表明,BHR和DHEA能够恢复POI小鼠的激素紊乱。
4、BHR恢复卵巢形态和卵泡发育
D28 HE染色显示模型组卵巢损伤,其特征是卵巢卵泡减少,颗粒细胞排列紊乱,卵泡闭锁增加,卵巢纤维化严重(图3E), HBHR明显改善了这种情况。原始卵泡的数量是卵巢储备的一个指标。模型组小鼠原始卵泡、原发性、继发性和窦性卵泡明显减少,闭锁卵泡增多,经HBHR治疗后明显改善。相反,LBHR或DHEA治疗仅能部分改善卵泡发育(图3F-J)。结合发情周期、FSH、LH、E2、AMH和卵泡计数结果,提示BHR治疗可改善POI小鼠卵巢功能障碍,包括卵巢储备和内分泌功能。
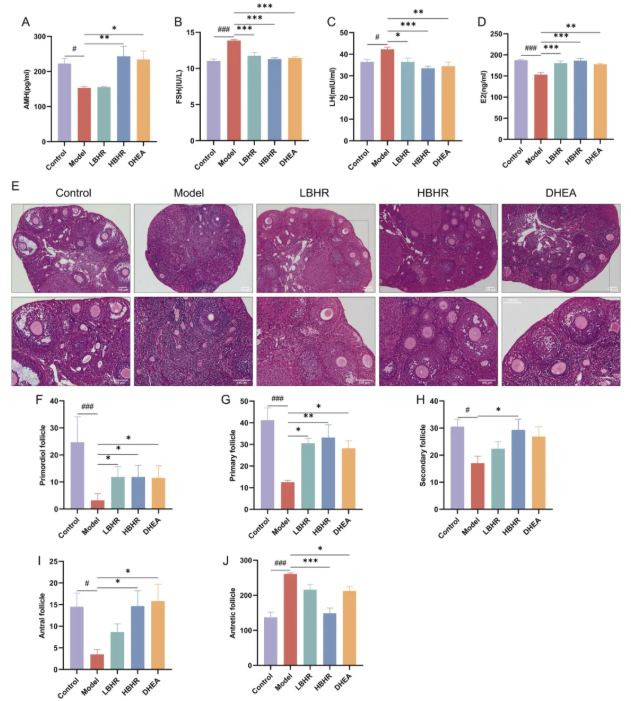
图3.BHR对卵巢、卵泡发育及血清激素水平的影响
5、BHR促进POI小鼠卵巢血管生成
CD31通常位于血管内皮细胞上,用于标记微血管。研究发现,模型组中CD31阳性细胞较少,而与模型组相比,BHR治疗导致黄体和卵泡腔周围CD31阳性细胞显著增加。随后,对阳性细胞进行量化(图4A)。与对照组相比,模型组阳性细胞数量明显减少,BHR处理后情况正好相反(图4D-E)。VEGF和bFGF在卵巢血管生成、卵泡发育和恢复发情周期中发挥关键作用。此外,bFGF和VEGF主要在卵母细胞、颗粒细胞和卵泡细胞中表达(图4B-C和F-G)。与对照组相比,模型组bFGF和VEGF蛋白和mRNA水平均明显降低,而BHR处理导致POI小鼠中其表达升高。
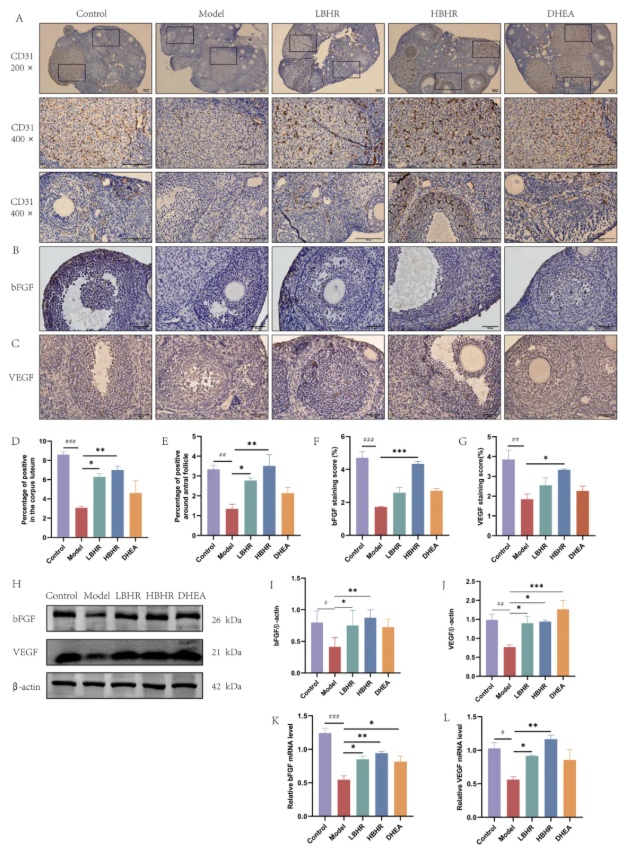
图4.BHR促进POI小鼠卵巢血管生成
6、BHR促进内源性BMSCs的增殖和归巢
根据BMSCs的表面标记,鉴定出内源性BMSCs比例(图5A)。与对照组相比,模型组中骨髓BMSCs的比例显著下降,随后在给药BHR后显著增加(图5B和5E),这可能归因于CTX诱导的骨髓抑制。相反,与对照组相比,模型组外周血中BMSCs的比例明显增加(图5C和5F),这可能是由于CTX诱导的组织损伤促使BMSCs从骨髓迁移到血液中。与模型组相比,BHR治疗导致外周血中BMSCs比例更高,DHEA治疗未观察到这种影响。此外,模型组卵巢中BMSCs的比例显著大于对照组(图5D和5G),表明卵巢损伤可能刺激BMSCs向损伤部位归巢。然而,CTX诱导的骨髓抑制和损伤卵巢微环境的变化可能会阻碍内源性骨BMSCs归巢的数量和效率。与模型组相比,HBHR处理显著增加卵巢中BMSCs的比例,表明HBHR处理促进了内源性BMSCs的归巢。
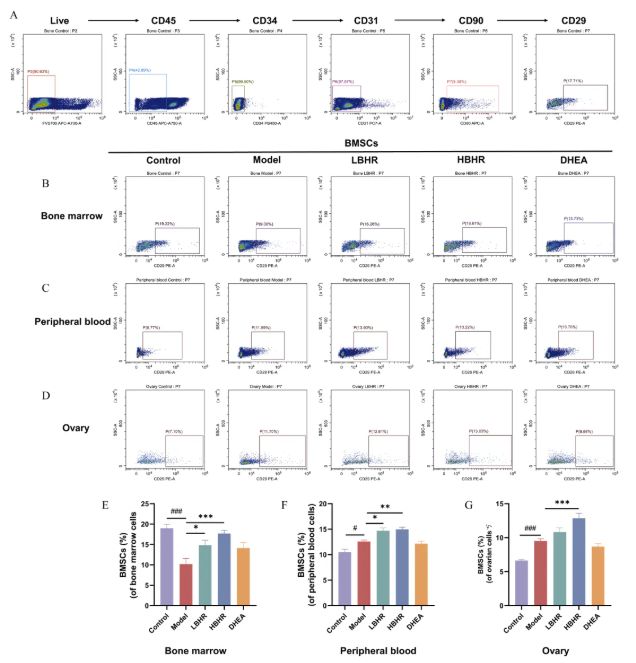
图5.BHR对POI小鼠骨髓、外周血和卵巢BMSCs百分比的影响
7、BHR上调POI小鼠卵巢中HGF/cMET和SDF-1/CXCR4通路
HGF/cMET和SDF-1/CXCR4通路对于促进BMSCs的归巢至关重要。与对照组相比,模型组卵巢中HGF、CMET和SDF-1蛋白和mRNA水平明显升高,HBHR治疗后进一步升高(图6A)。有趣的是,虽然CXCR4在模型组中mRNA水平明显升高,但在蛋白质水平上仅略有上升趋势。然而,与模型组相比,HBHR组中CXCR4的表达明显升高(图6F-J)。免疫荧光分析显示,HGF和SDF-1在卵泡中主要表达,而cMET和CXCR4主要定位于卵泡周围的间质区,提示骨髓间充质干细胞归巢于卵巢间质组织(图6E)。综上所述,HBHR治疗显著提高了HGF/cMET和SDF-1/CXCR4的水平。
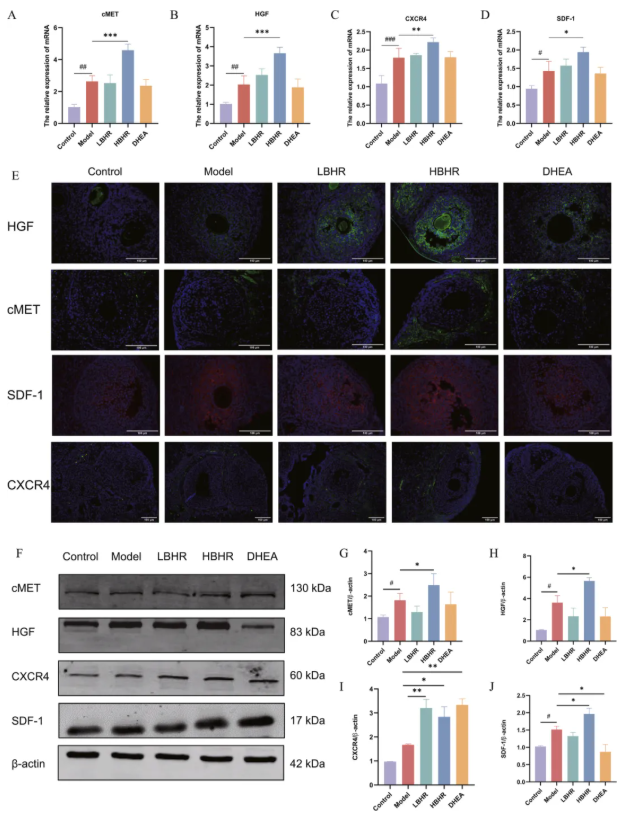
图6.BHR对POI小鼠卵巢HGF/cMET和SDF-1/CXCR4表达的影响
8、BHR对BMSCs增殖的影响
BMSCs呈贴壁生长,呈成纤维细胞形态,在密集分布时能够以极化方式排列(图7A)。BHR浓度超过1 mg/ml时,BMSCs的生长受到抑制,因此选择0.5 mg/ml和1 mg/ml浓度的LBHR和HBHR处理(图7B)。PCNA在细胞核中的定位是细胞增殖的可靠标志(图7D)。与对照组(0 mg/mlBHR)相比,HBHR处理导致PCNA蛋白和mRNA水平的表达增加,而LBHR处理仅增加PCNA mRNA水平(图7E-G)。结果表明,BHR具有促进骨髓间充质干细胞增殖的潜力。
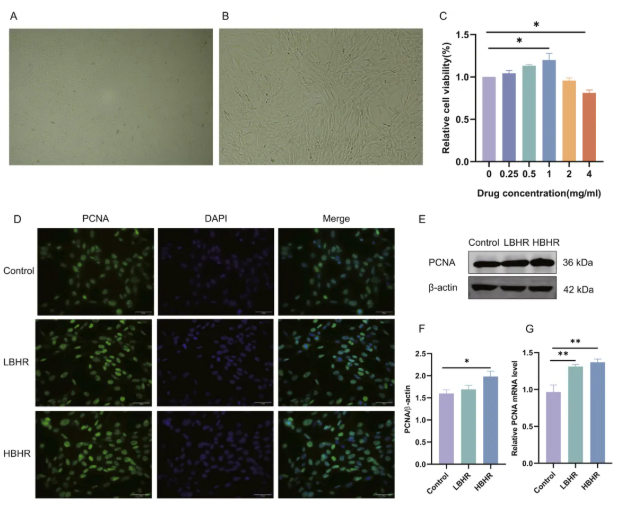
图7.BHR促进BMSCs体外增殖
9、BHR促进BMSCs在体外的迁移
使用不同浓度的BHR(0、0.5和1 mg/ml)进行划痕愈合和Transwell实验,以评估BHR对BMSCs迁移能力的影响。结果表明,HBHR (1 mg/ml)处理在12 h和24 h显著增强BMSCs的迁移,而LBHR (0.5 mg/ml)处理在24 h明显促进BMSCs的迁移(图8a和8G)。Transwell迁移实验显示,与对照组相比,BHR处理后通过膜的BMSCs数量显著增加(图8b和8H)。随后,为了探究BHR促进BMSCs迁移的机制,检测了BMSCs中cMET和CXCR4的表达。与对照组相比,HBHR组cMET和CXCR4蛋白和mRNA水平均显著升高,而LBHR未表现出相同的效果(图8D-F和8I-J)。
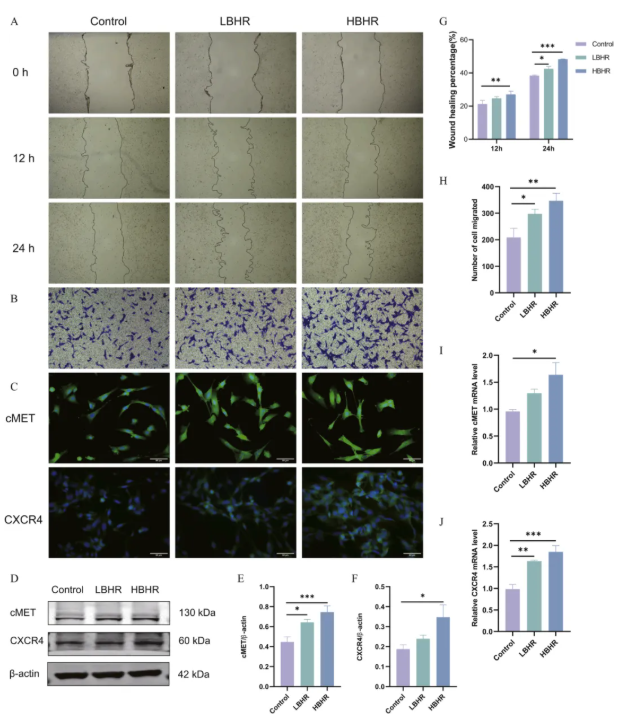
图8.BHR促进BMSCs的体外迁移
研究结论
总之,目前的研究结果表明,BHR在几个与POI相关的方面起着至关重要的作用。首先,它抑制卵泡闭锁,促进卵泡生长,改善内分泌失调,恢复卵巢储备。二是调节VEGF和bFGF的表达,促进卵巢血管生成。最后,它促进BMSCs的增殖、迁移和归巢到卵巢,这可能与SDF-1/CXCR4和HGF/cMET信号轴有关(图9)。然而,BHR对CTX诱导的POI小鼠卵巢储备和卵巢功能的改善作用是否与其促进内源性骨髓间充质干细胞的增殖和迁移有关,还有待进一步研究。BHR和BMSCs之间在POI改善中的微妙联系表明,TCM“肾治骨生骨髓”理论与“肾治生殖”理论之间可能存在联系,这可能为探索TCM理论的科学性奠定基础。
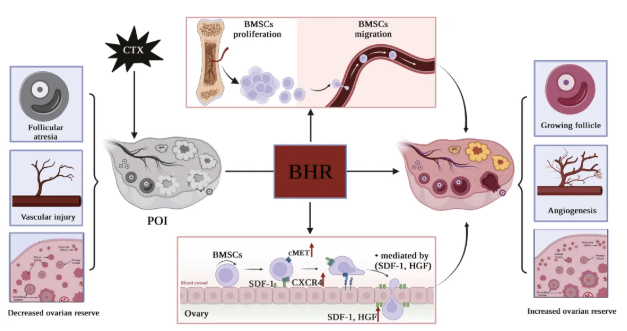
图9.BHR对CTX诱导的POI小鼠的作用及其机制示意图
DIA中药入血组:百趣生物创新性地运用DIA数据采集模式采集血清中的中药药物成分,从数据采集上避免入血/入组织药物信息的遗漏,尽可能全面采集进入血液和组织的中药药物成分。并通过检索百趣生物自建中药标准品数据库和中药专属数据库,对血液样本或组织样本中的药效成分进行准确鉴定,同时结合药物成分在体内的代谢变化,并通过深入的分析内容呈现中药治疗疾病的作用机制。









