

英文标题:Lysine L-lactylation is the dominant lactylation isomer induced by glycolysis
中文标题:赖氨酸L-乳酸化修饰(lysine L-lactylation)是糖酵解诱导产生的主要乳酸化异构体
发表期刊:nature chemical biology
影响因子:13.7
文章简介
芝加哥大学赵英明教授、威斯康星大学麦迪逊分校的李灵军教授、四川大学的戴伦治教授以及北京大学的张迪教授等团队在国际权威期刊nature chemical biology上发表了题为“Lysine L-lactylation is the dominant lactylation isomer induced by glycolysis”的最新研究成果。该研究开发了区分赖氨酸乳酸化三种异构体的技术,证实赖氨酸L-乳酸化(KL-la)是组蛋白上的主要异构体,且是糖酵解和瓦伯格效应的主要响应者,同时明确其前体乳酸辅酶 A(lactyl-CoA)与KL-la水平正相关。
研究背景
赖氨酸乳酸化修饰是由L-乳酸驱动的新型蛋白质翻译后修饰(PTM),在代谢与表观遗传调控的关联中具有关键意义,但其存在的三种异构体——赖氨酸L-乳酸化(KL-la)、d-乳酸基-赖氨酸(KD-la)与N-ε-(羧乙基)-赖氨酸(Kce),因分子量相同、结构相似,常规 HPLC-MS技术难以区分,导致三者在瓦伯格效应及核内修饰功能研究中长期混淆,严重阻碍对其真实生物学功能的认知。
前期研究已明确:KL-la由糖酵解衍生的L-乳酸驱动形成,推测乳酸辅酶A(lactyl-CoA)是其形成的高能中间物,p300可催化组蛋白KL-la形成,HDAC1-3、SIRT2参与去修饰;KD-la由蛋白质与乙二醛酶途径产物LGSH非酶促生成;Kce是糖酵解副产物MGO与赖氨酸的加合物,且组蛋白上Kce水平远低于精氨酸修饰。
但关键问题仍待解决:三种异构体在组蛋白上的主要存在形式不明确;三者对糖酵解动态变化的响应模式未系统探究;lactyl-CoA在细胞内的存在、代谢来源及与KL-la的关联性缺乏直接证据,且学界对三者生化机制与功能差异存在争议,部分研究质疑KL-la真实性及lactyl-CoA存在。因此,开发可靠的异构体区分方法、厘清其与糖酵解的关系,成为深入理解代谢-表观调控轴的迫切需求。
技术路线
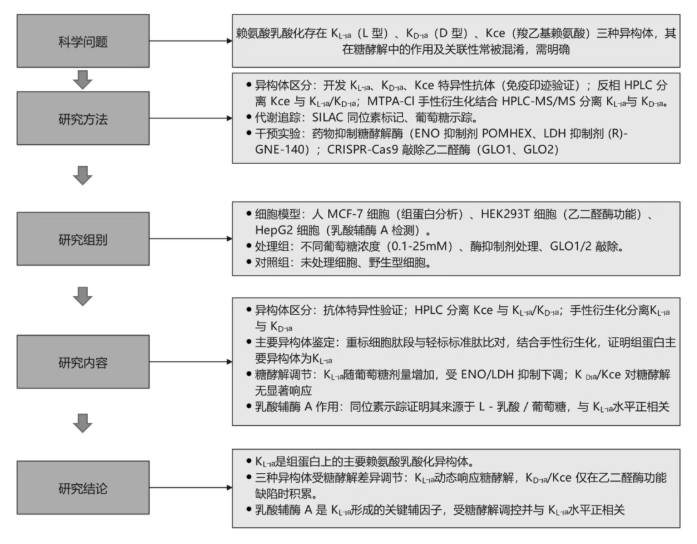
研究结果
1、高效液相色谱(HPLC)可将Kce肽与KL-la或KD-la肽分离
翻译后修饰(PTM)特异性抗体可区分赖氨酸L-乳酸化(KL-la)、赖氨酸D-乳酸化(KD-la)和N-ε-(羧乙基)-赖氨酸(Kce)(图1)。本研究中,研究人员开发了第二代兔单克隆泛抗KL-la抗体,以及泛抗KD-la和泛抗Kce抗体。为探究这些试剂的有效性,研究人员进行了免疫印迹实验(图2a),检测合成肽库(图2b-d)、化学修饰的牛血清白蛋白(BSA)(图2e-g)和合成的序列特异性组蛋白肽(图2h-j)。结果显示,泛抗KL-la、泛抗KD-la和泛抗Kce抗体对各自对应的PTM具有特异性,比对其他修饰的偏好性高至少50倍(图2b-j)。
随后该研究利用HPLC实验区分KL-la、KD-la和Kce,结果发现尽管带有KL-la或KD-la的肽对无法分离,但通过反相HPLC可以轻松区分它们与带有Kce的对应肽(图3a-b)。
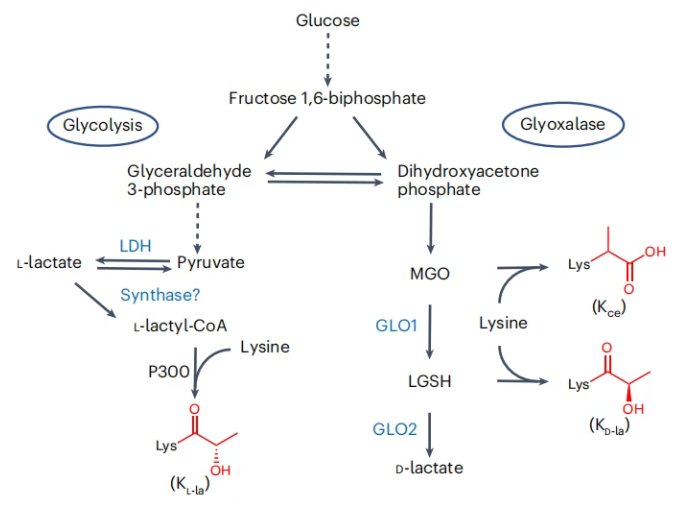
图1. KL-la、KD-la和Kce是与糖酵解相关的结构异构体
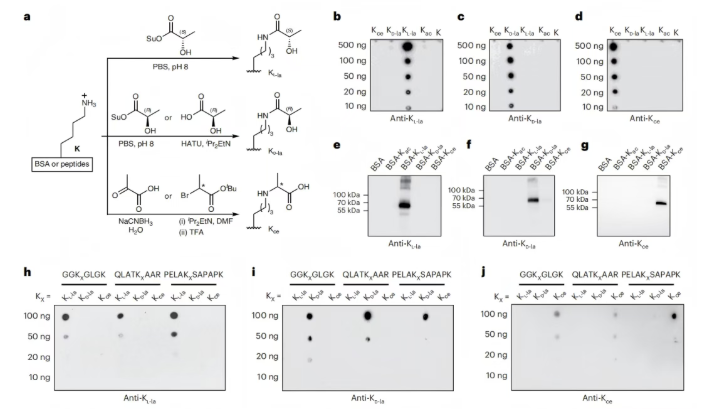
图2. PTM特异性抗体可区分KL-la、KD-la和Kce
2、手性反应结合HPLC实现KL-la与KD-la的分离
研究人员利用经典的Mosher酸氯化物(MTPA-Cl)手性衍生化反应,该反应可以放大手性差异,从而提高色谱分离的可能性(图3c)。为探究这种可能性,研究人员首先将肽消化成氨基酸,再经过MTPA-Cl衍生化后,进行HPLC-MS/MS分析(图3d)。结果发现,(MTPA)2-KL-la和(MTPA)2-KD-la能得到很好的分离(图3e),且在MS/MS中具有相同的碎片模式(图3f)。
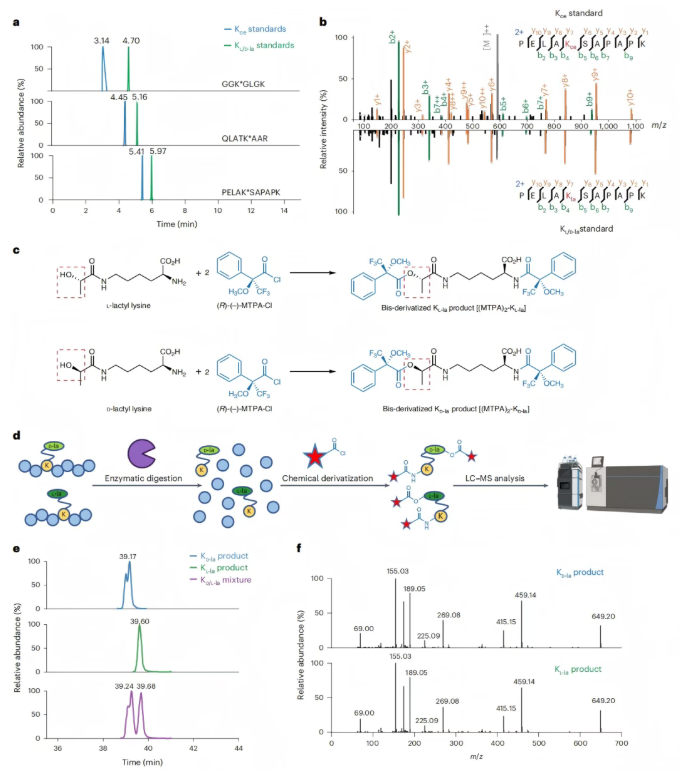
图3. 通过HPLC-MS/MS分离含KL-la、KD-la和Kce的多肽
3、KL-la是组蛋白上的主要乳酸化异构体
研究证实,KL-la是组蛋白上的主要修饰,而非KD-la或Kce。 研究人员通过“重标”培养基(含K8[¹³C₆,¹⁵N₂]标记L-赖氨酸)培养人MCF-7细胞,富集组蛋白修饰肽段后,与“轻标”(K0[¹²C₆,¹⁴N₂])KL-la、KD-la和Kce标准肽混合,进行HPLC-MS/MS 分析(图4a)。结果显示,细胞来源肽段与KL/D-la标准肽保留时间及碎片模式一致,与Kce标准肽不一致,表明组蛋白主要修饰为KL/D-la而非Kce(图4b)。
为明确是KL-la还是KD-la,研究人员将富集肽段消化为氨基酸后进HPLC-MS/MS分析,结果显示,细胞来源产物与KL-la产物共洗脱,证明组蛋白乳酸化主要为L型(图4c-d)。 基于SILAC的定量质谱验证显示,高葡萄糖诱导62个KL-la修饰组蛋白肽段,核心组蛋白KL-la对高葡萄糖响应更显著,且未检测到KD-la或Kce修饰(图4e-f)。 综上数据,细胞组蛋白的三种赖氨酸乳酸化结构异构体中,KL-la是主要异构体。
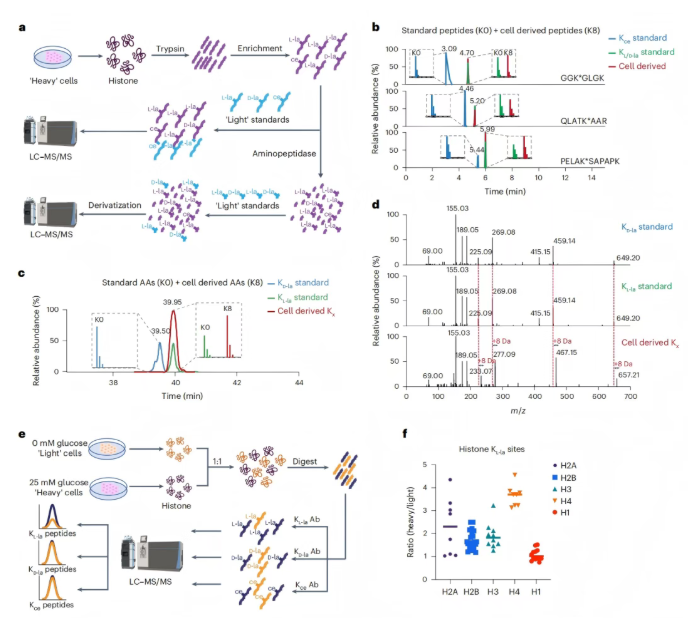
图4. KL-la是细胞组蛋白上最常见的翻译后修饰
4、糖酵解对KL-la、KD-la和Kce的调节存在差异
KL-la、KD-la和Kce均由糖酵解中间产物作为前体形成(图5a)。研究人员在含不同葡萄糖浓度的培养基中培养人MCF-7细胞,通过蛋白质印迹法检测发现,组蛋白和非组蛋白上的整体KL-la水平被葡萄糖以剂量依赖方式诱导,而KD-la和Kce水平对细胞外葡萄糖浓度基本无响应(图5b)。
为探究糖酵解关键步骤对三种异构体的调控作用,研究人员通过抑制烯醇化酶(ENO)或乳酸脱氢酶(LDH)干扰糖酵解过程(图5a),结果显示,ENO抑制剂POMHEX以剂量依赖方式降低整体KL-la水平,同时使KD-la水平增加,Kce水平受轻微影响(图5c);而LDH抑制剂(R)-GNE-140仅特异性降低整体KL-la水平,对KD-la和Kce无影响(图5d)。 为进一步明确乙二醛酶途径的作用,研究人员将GLO1缺陷、GLO2缺陷和GLO1/2双缺陷的人胚胎肾(HEK)293T细胞,分别培养于含不同葡萄糖浓度的培养基中。检测结果表明,整体KL-la对葡萄糖浓度有灵敏响应,但不受乙二醛酶(GLO1/GLO2)调节;KD-la仅在GLO2缺失时被诱导,对葡萄糖浓度变化敏感性低;仅GLO1缺失时Kce水平未增加(图5e)。 综上,KL-la、KD-la和Kce在糖酵解过程中受不同调节,乙二醛酶途径可防止细胞中KD-la和Kce的形成,而不影响对糖酵解敏感的KL-la。
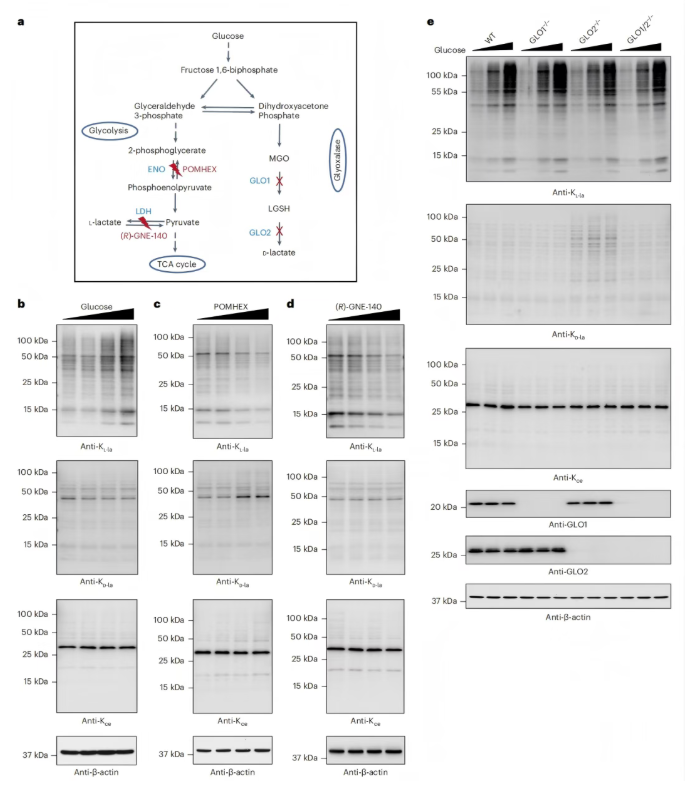
图5. 糖酵解对KL-la、KD-la和Kce的差异调控
5、乳酸辅酶A与KL-la在响应糖酵解时相关
研究人员提出乳酸辅酶A是KL-la形成的辅因子,且乙酰转移酶p300可利用化学合成的乳酸辅酶A作为体外酶促组蛋白KL-la反应的辅因子。为验证该结论,实验首先确认了培养细胞中乳酸辅酶A的存在(图6a-b)。通过¹³C₃-L-乳酸和U-¹³C₆-D-葡萄糖同位素示踪实验发现,乳酸辅酶A和乙酰辅酶A均能被外源性¹³C₃-L-乳酸快速标记,4小时后标记减少,且乳酸辅酶A的最大标记远高于乙酰辅酶A,丙酰辅酶A未被标记(图6c);用U-¹³C₆-D-葡萄糖处理细胞,结果显示,乙酰辅酶A标记比乳酸辅酶A快得多,丙酰辅酶A未被标记(图6d),表明乳酸辅酶A可从L-乳酸和葡萄糖代谢衍生而来。 在ENO或LDH被阻断的细胞中测量显示,POMHEX处理后乳酸辅酶A水平显著降低;LDH缺陷细胞或经(R)-GNE-140处理的细胞中,乳酸辅酶A水平也远低于对照细胞(图6e-f),表明乳酸辅酶A受糖酵解动态调节,并与KL-la水平呈正相关。
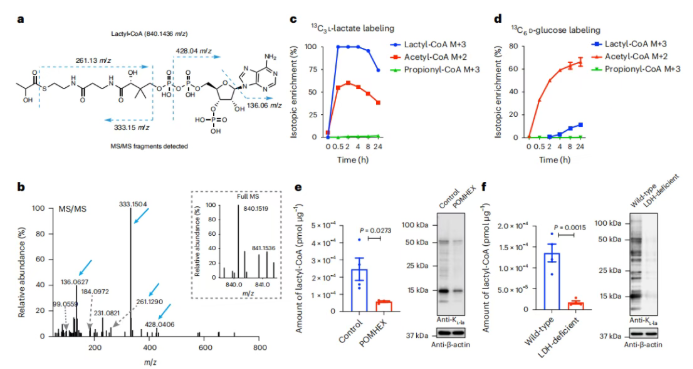
图6. 在糖酵解过程中,乳酰辅酶A与KL-la呈正相关
研究结论
本研究为深入理解蛋白质翻译后修饰的复杂性奠定了基础,特别是在糖酵解相关的代谢调控和表观遗传调控交叉领域。通过明确KL-la作为主要响应糖酵解的异构体,为后续研究其在生理和病理过程中的功能作用提供了关键依据,同时也为开发针对特定异构体的调控手段开辟了新的方向。
乳酸化修饰(Lactylation):是一种蛋白质翻译后修饰,乳酸(Lactic)和辅酶A(CoA)在特定酶的作用下结合,形成乳酰辅酶A(Lactyl-CoA),作为乳酸化修饰的供体,再由特定的乳酸转移酶将乳酸基团转移到蛋白质的赖氨酸残基上,发生乳酸化修饰。这一过程改变了蛋白质的电荷状态、结构和功能,从而影响蛋白质的活性、定位以及与其他分子的相互作用,进一步调控广泛的细胞生理过程和病理状态。









