
英文标题:Liquid crystal monomers induce placental development and progesterone release dysregulation through transplacental transportation
中文标题:液晶单体跨胎盘转运诱导胎盘发育和孕酮释放异常
发表期刊:nature communications
影响因子:15.7
客户单位:南开大学
百趣提供服务:转录组测序、Label free定量蛋白质组学
研究背景
由于现代社会化学品的广泛使用,胎儿在妊娠期间会暴露于经胎盘转运的各种环境污染物(如有机化合物、黑碳颗粒和重金属),多个流行病学调查已揭露其潜在负面影响。液晶单体(Liquid Crystal Monomers, LCMs)是室内环境中常见的新兴污染物,广泛用于智能手机、电脑和电视等设备的液晶显示器。然而,当前尚缺乏关于妊娠期暴露于LCMs的研究。基于定量结构-性能关系模型,1431种市售LCMs中80%以上可能会对人类健康产生不利影响。因而,研究人员假设,妊娠期暴露于LCMs,经胎盘转运可能会影响胎盘发育。
为建立化学污染物母婴暴露特征、跨胎盘转运和毒性效应评价体系,首先收集93对产妇血清-新生儿脐带血清样本,通过GC-MS监测样本中56种LCMs水平,明确暴露特征和风险;接着建立大鼠子宫灌注模型,通过对大鼠腹部血管直接插管,模拟LCMs从动脉进入-跨胎盘转运-进入胎鼠体内-回流逆向跨胎盘转运-从静脉流出的动态过程,明确LCMs的跨胎盘转运规律;并利用蛋白质组学、等温滴定量热法(ITC)、免疫组化(IHC)、实时逆转录聚合酶链反应(RT-qPCR)和分子对接分析,探索LCMs经胎盘转运的模式和机制。最后对胎盘细胞系进行转录组学分析、RT-qPCR、蛋白免疫印迹(WB)、免疫荧光和LC-MS/MS检测,评估LCMs对胎盘细胞的细胞毒性。
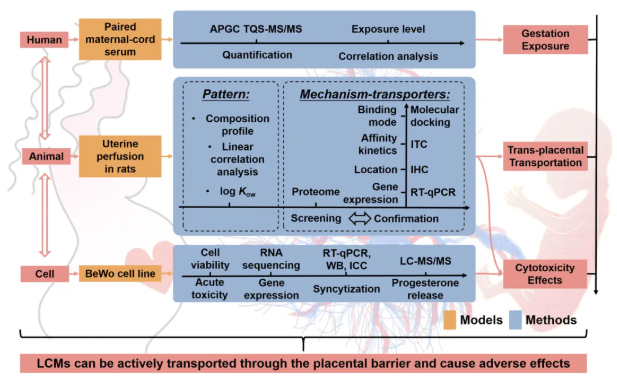
图1. 研究设计总览
研究结果
1、妊娠期暴露于LCMs的直接证据
为了确定孕妇和胎儿的生物样本中是否存在LCMs,研究人员收集了93个配对的母体和脐带血清样本,检测了56个LCMs(图2a)。GC-MS结果显示,14种LCMs存在于母体和脐带血清中,总浓度(ΣLCMs)分别为4.03-231 ng/mL(中位数:13.9 ng/mL)和 3.91-175 ng/mL(中位数:18.1 ng/mL)(图2b)。Spearman关联分析显示,LCMs水平在母体血清样本、脐带血清样本内以及母体血清样本和脐带血清样本间彼此相关(图2c);ΣLCMs水平也是如此(图2d)。此外,主成分分析显示母体和脐带血清样本之间的LCMs谱相似(图2e)。由此可知,妊娠期通过胎盘转运暴露于LCMs。
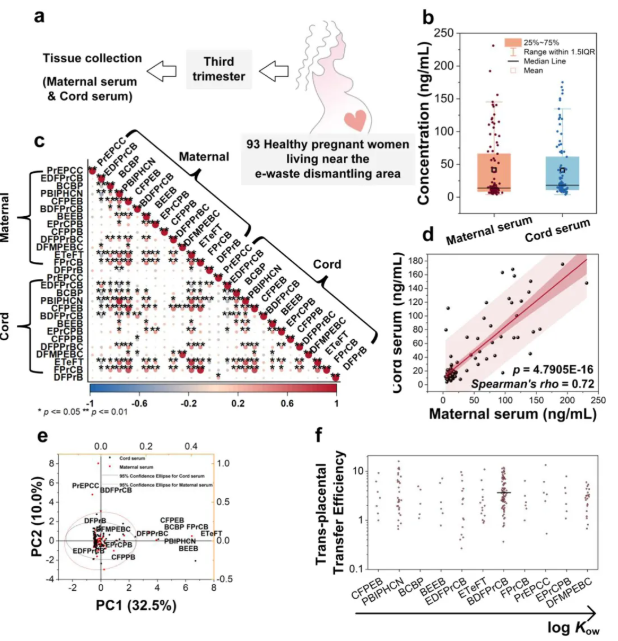
图2. 配对母体-脐带血清样本中LCMs的检测
2、大鼠子宫灌注模型中LCMs经胎盘转运的机制
被动扩散是小分子穿过胎盘的重要途径,其终点是膜两侧输送物质的浓度相等,此时跨胎盘转移效率(Transplacental Transfer Efficiency, TTE)为1。有14个LCMs穿过胎盘屏障,TTE值差别很大(图2f),这表明它们经胎盘转运不仅依赖于被动扩散,也可能由胎盘转运蛋白介导。
为了探索具体的分子机制,研究人员建立了大鼠子宫灌注模型。在这个模型中,除怀孕大鼠的生殖动脉和静脉外的所有血管都被结扎以形成人工胎盘屏障。将21个LCMs的混合物分别以低剂量(10 ng/mL,相当于在脐带血清样本中检测到的LCMs浓度)、中剂量(1000 ng/mL)和高剂量(5000 ng/mL)添加到灌注液中(图3a)。灌注的LCMs在大鼠胎盘和胎儿中存在,多数在胎盘组织中积累(图3b)。胎盘、胎儿中LCMs积累与灌注剂量之间存在显著线性相关LCMs在胎盘和胎儿中的累积存在显著正相关,表明被动扩散介导了LCMs经胎盘转运。总的来说,LCMs可轻易穿过胎盘屏障,被动扩散介导LCMs经胎盘转运。
为了进一步了解脂溶性如何影响LCMs的经胎盘转运,研究人员对大鼠胎盘中的辛醇-水分配系数(Octanol-Water Partition Coefficient, Kow)和LCMs进行了spearman相关性分析。结果显示,中-高剂量组中二者呈显著负相关,低剂量组中无显著相关(图3c-e),表明当以相对高剂量给药时,对于log Kow为4.37-9.5的LCMs而言,其亲脂性越强,在胎盘中积累的可能性就越小。上述证据表明脂溶性影响中高剂量LCMs的经胎盘转运,且LCMs的浓度依赖性被动扩散介导了经胎盘转运。
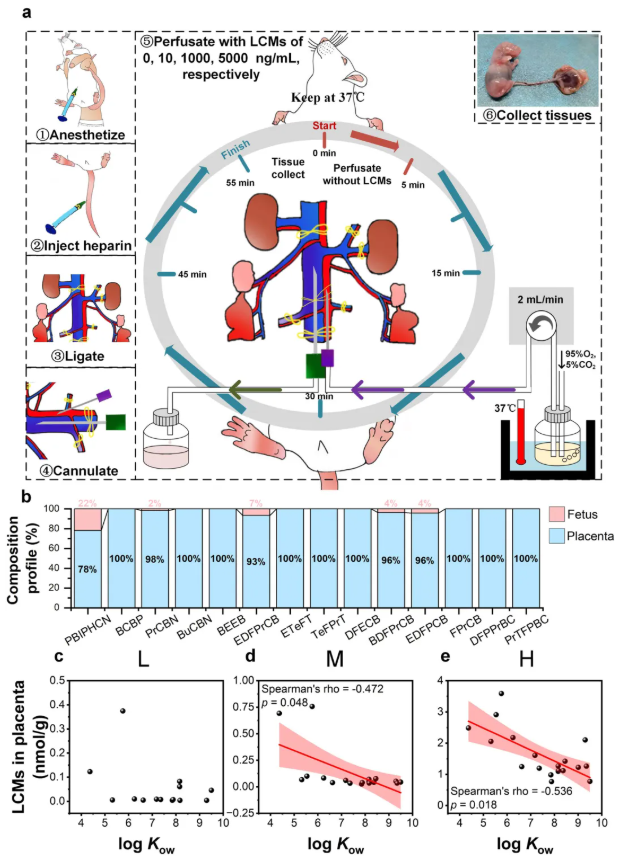
图3. LCMs在大鼠胎盘中的跨胎盘转运
3、芳香族氨基酸转运蛋白1(SLC16A10)参与LCMs的主动转运
研究人员假设胎盘转运蛋白可能参与LCMs的经胎盘转运。为此,利用蛋白质组学分析评估了胎盘转运蛋白在大鼠胎盘中的表达。基于本研究及既往研究,选取拥有高检出率和生物利用度的PBIPHCN作为代表性的LCM。低、中、高剂量三个处理组中大鼠胎盘的蛋白质组学表达谱均同对照组存在显著差异,PCA 图显示三个剂量组间蛋白质表达差异同样显著。基因本体生物学过程结果显示,与对照组相比,低、中、高剂量组分别显著富集了27、19和20条与跨膜转运相关的通路(图4a)。其中,9条通路在三组均显著富集,12条通路在低-中剂量组中显著富集,15条通路在低-高剂量组中显著富集(图4a)。这些途径与胺类有机化合物(如酰胺、钴胺素、唑类)、胺类激素(如甲状腺激素)和氨基酸(如L-组氨酸)有关(图4b)。
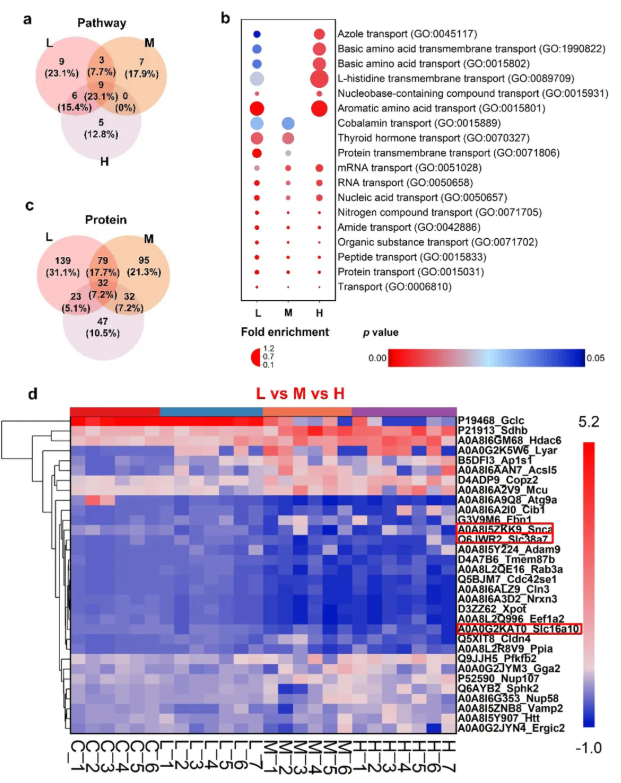
图4. 大鼠胎盘转运蛋白表达
为了鉴定参与PBIPHCN经胎盘转运的特定蛋白,研究人员特别关注跨膜转运通路中显著富集的差异表达蛋白(T-DEPs)。与对照组相比,低、中和高剂量组分别有273、238和134个T-DEPs(图4c)。三组共有的T-DEPs有32个(图4c-d),其中芳香族氨基酸转运蛋白1(Slc16a10)、钠偶联中性氨基酸转运蛋白7(Slc38a7)和α-突触核蛋白(Snca),因其内源性底物与PBIPHCN的结构相似而被用于后续研究(图5a)。在三组中均表达降低的Slc16a10(图5b)是一种甲状腺激素和芳香酸转运蛋白,其下调是甲状腺激素信号通路(KO04919)和甲状腺激素合成(KO04918)富集的关键因素。Slc38a7在三组中均表达上调(图5c)。UniProt功能分析表明,Slc38a7同向转运蛋白选择性地将钠离子和氨基酸(如L-谷氨酰胺和L-天冬酰胺)从溶酶体共转运到细胞质中,并可能参与mTORC1激活。三组中Snca的表达同样均下调(图5d),它通过与多巴胺转运蛋白结合并调节其活性来帮助调节多巴胺神经传递。此外,GSEA分析显示,多巴胺能突触通路(KO04728)在三组中都富集。
为了确定这三种转运蛋白是否参与PBIPHCN的经胎盘转运,研究者开展了RT-qPCR和分子对接分析。Slc16a10、Slc38a7和Snca表达在mRNA水平上调,低剂量组的Slc38a7除外(图5e-g)。Slc16a10/Slc38a7/Snca和PBIPHCN之间的结合亲和力较之Slc16a10/Slc38a7/Snca自身与其相应的内源性底物更高(图5h–j)。由于L-色氨酸和PBIPHCN的结构相似性,研究人员选择了Slc16a10做进一步验证。他们通过ITC测定PBIPHCN与纯化的Slc16a10之间的结合亲和力(图5k-l),检测到PBIPHCN和Slc16a10之间存在强相互作用,解离常数(KD)为0.356 μM。IHC结果显示,Slc16a10位于大鼠胎盘滋养层细胞的顶膜(图5m-n),起着分离母体血液和胎儿血管的作用,这表明Slc16a10可能是PBIPHCN从母体血管转运到滋养层细胞的流入通道。人类样本中的IHC分析结果与之类似。
为了研究人胎盘中SLC16A10的沉默是否真的改变了PBIPHCN的细胞积累,他们对BeWo细胞进行了SLC16A10的基因敲低,并对PBIPHCN的细胞积累进行了定量分析(图5o)。结果表明,在0.05和5 μM的暴露剂量下,BeWo中SLC16A10的沉默致使细胞内PBIPHCN积累显著减少,进一步表明SLC16A10参与PBIPHCN的经胎盘转运。总的来说,PBIPHCN可通过SLC16A10介导的主动转运穿过胎盘屏障。
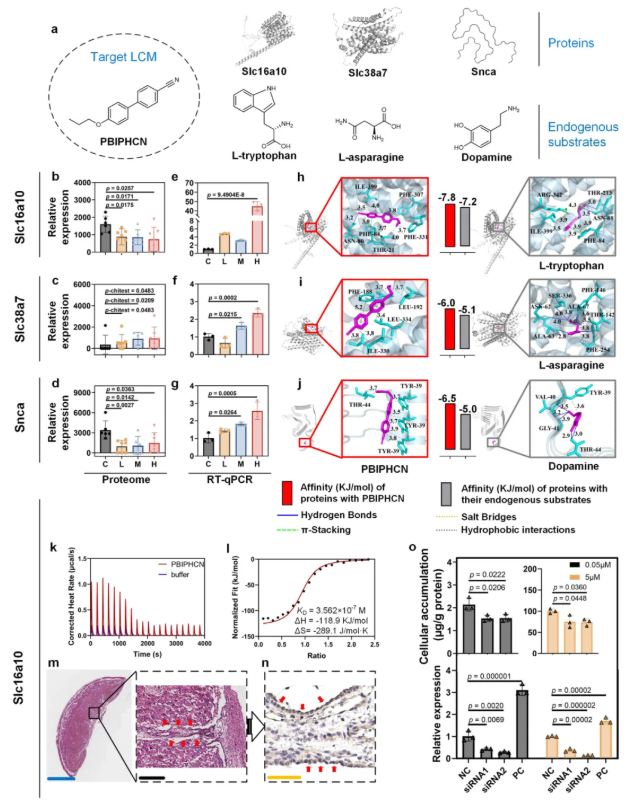
图5. 潜在LCM转运蛋白鉴定
4、PBIPHCN的细胞毒性作用
研究人员通过CellTiter-Lumi Plus发光试验研究了PBIPHCN对细胞滋养层细胞(CTBs)和多核合体滋养层细胞(STBs)的细胞毒性,发现总体而言,PBIPHCN对合体化BeWo细胞的毒性高于非合体化细胞。随后,他们通过用5 μM(低剂量组)、50 μM(中剂量组)、500 μM(高剂量组)PBIPHCN处理合体化的BeWo细胞并进行RNA测序分析。结果表明,低、中、高剂量组分别有195、37和673个基因下调,206、28和138个基因上调(图6a)。GO分析表明,差异表达基因与多种生物过程、细胞成分和分子功能有关(图6b),特别是暴露于低剂量和高剂量组的PBIPHCN会影响BeWo细胞中与胎盘发育和孕酮释放相关的基因,类似于大鼠胎盘扩散模型中的结果(图6c-d)。
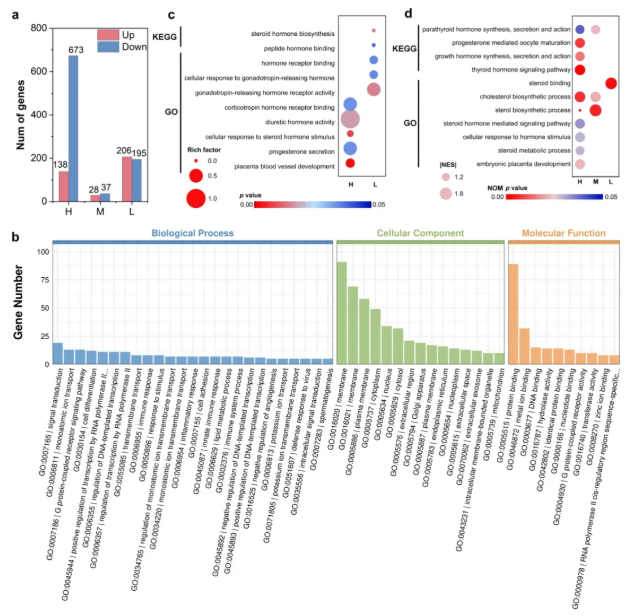
图6. PBIPHCN细胞毒性
5、PBIPHCN对滋养层合体化及孕酮释放的影响
在人体胎盘中,CTBs不断与上覆的STBs融合,以维持屏障功能和运输活动,这对胎盘发育至关重要。因此,研究者假设PBIPHCN会抑制合体化。为了验证这一点,在合体化过程中将PBIPHCN添加到BeWo细胞的生长培养基中。WB和RT-qPCR结果显示人绒毛促性腺激素(hCGB)和卵母细胞样转录抑制因子1(OVOL1)表达显著下调(图7a-c)。免疫荧光染色(Immunofluorescence staining, IF)证实PBIPHCN浓度对hCGB表达的抑制作用是剂量依赖性的,细胞核数量和核合体化程度亦随着PBIPHCN剂量的增加而降低(图7d)。更重要的是,在PBIPHCN暴露下,培养基中的hCG释放显示出类似的下降趋势(图7e)。总体而言, PBIPHCN抑制滋养层合胞体化。
为了确定PBIPHCN对孕酮释放的影响,将合体化的BeWo细胞暴露于PBIPHCN,并测定孕酮在24或48小时内的释放量,与未处理的细胞相比,24小时内孕酮释放量显著减少。以上发现表明PBIPHCN影响胎盘发育和孕酮释放。
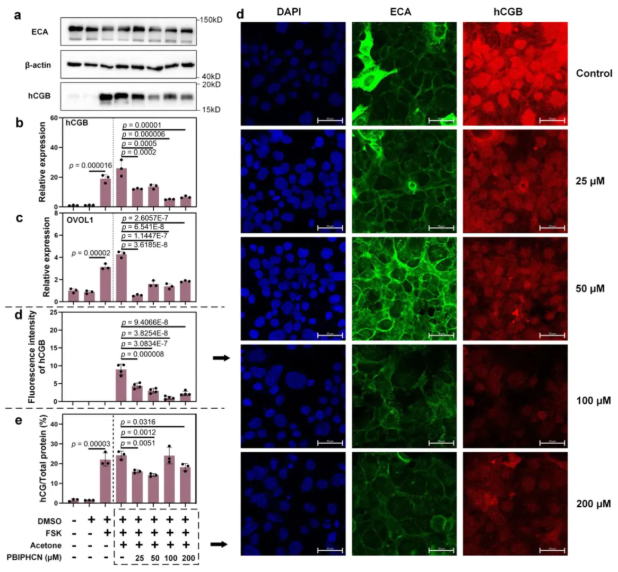
图7. PBIPHCN对BeWo细胞合胞体化及相关分子表达的影响
5、LCMs混合物的细胞毒性作用
为了更全面地了解LCMs的毒性,研究者将母体或脐带血清样本中检测到的LCMs分为非氟化LCMs(NF-LCMs)和氟化LCMs(FLCMs),并进行了CellTiter-Lumi Plus发光检测和RNA测序。转录组结果表明,低浓度时NF-LCMs和F-LCMs有相似的基因表达,而中高浓度时NF-LCMs有更多的基因表达失调;GO和KEGG分析表明差异基因的表达与胚胎发育和激素释放相关,GSEA分析表明差异基因在固醇和类固醇合成及孕酮介导的卵母细胞成熟通路富集。此外,LCMs混合物也影响孕酮的释放。由此可推断,LCMs混合物对胎盘细胞有毒性作用,影响胎盘发育和孕酮释放。
研究结论
研究开发了一个综合人体生物监测、孕鼠子宫灌注和胎盘细胞的评估系统,通过多组学检测和分子生物学结合的方法,发现SLC16A10介导的LCMs经胎盘转运抑制胎盘发育和孕酮释放。该研究为评估其他污染物或药物对孕妇和胎儿的潜在健康影响奠定了坚实的基础。
转录组测序,聚焦特定细胞功能状态下全RNA(含mRNA与非编码RNA),无需预设计已知序列探针,可检测任意物种整体转录活动,借高通量平台提供精准数字化信号,实现更广范围、更高通量检测,能全面获取物种组织/器官转录本信息,用于基因表达、新转录本及结构变异等研究,具备单核苷酸水平检测、识别未知/稀有转录本、判定可变剪切与融合基因等优势,助力深入解析转录组复杂性。
Label free定量蛋白质组学,是一种不依赖于同位素标记的蛋白质定量技术,该技术通过液质联用对蛋白质酶解肽段进行检测,分析大规模鉴定蛋白质时所产生的质谱数据,对被检测到的离子峰强度进行积分,以积分面积进行相对定量。该技术操作简便,能减少样本预处理步骤,保留样本原始状态,适用于多种样本类型,可广泛应用于生物标志物发现、药物机制研究等领域,为蛋白质组学研究提供高效有力的支持。
若您对文中所述的“转录组测序/Label free定量蛋白质组学”等服务感兴趣,百趣生物可提供专业技术服务,欢迎后台私信咨询!









