
英文标题:Proteogenomic characterization reveals tumorigenesis and progression of lung cancer manifested as subsolid nodules
中文标题:蛋白质基因组学特征揭示表现为亚实性结节的肺癌的发生与进展
发表期刊:nature communications
影响因子:15.7
研究背景
低剂量计算机断层扫描(LDCT)筛查显著提高了表现为亚实性结节(SSNs)的早期肺癌检出率。这类肺癌主要包括原位腺癌(AIS)、微浸润腺癌(MIA)及部分浸润性腺癌(IAC),通常具有惰性生长特性且预后较好,但不同SSNs的生长异质性极强——快速进展的SSNs需手术切除,而稳定或缓慢生长的SSNs仅需定期CT监测,这给临床管理带来了巨大挑战。
现有研究已初步描绘了SSNs的基因组、免疫及代谢特征,揭示了其癌变和进展的部分分子事件,但对从癌前病变(AIS)到浸润性肺癌(IAC)进展过程中关键的蛋白质组学特征及翻译后修饰(PTMs,如磷酸化、糖基化)的动态变化仍缺乏深入理解。鉴于蛋白质丰度及功能改变(包括PTMs)在肿瘤细胞增殖、代谢、免疫应答等生物学过程中起核心作用,且糖基化等修饰已被证实可影响肿瘤细胞黏附、生长及信号传导,阐明这一过程的蛋白质基因组学特征对SSNs的精准管理至关重要。
研究概览
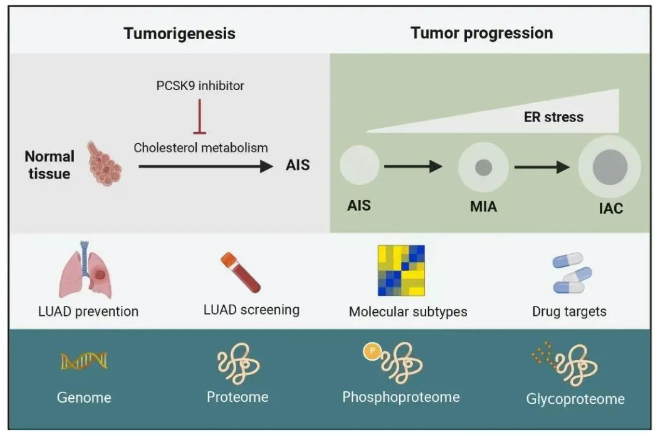
研究结果
1、SSN-LUAD的蛋白质基因组学景观
研究对66例放射学表现为亚实性结节(SSN)的肺腺癌(LUAD)及配对癌旁组织进行多组学分析,样本涵盖原位腺癌(AIS,17例)、微浸润腺癌(MIA,24例)和浸润性腺癌(IAC,25例),其病理分类符合国际肺癌研究协会(IASLC)标准。基于冷冻组织的蛋白质组学、磷酸化修饰组学及糖基化组学分析(图1B)显示,共鉴定出10,255种蛋白质、27,283个磷酸化位点及12,480种糖肽。单样本定量结果显示,肿瘤组织蛋白质中位数约为6,700(癌旁组织约6,000 vs 肿瘤组织约7,300);高置信度(定位概率>0.75)磷酸化位点约7,500个,糖肽约3,800个(图1C-E)。
糖基化异质性分析显示,28%的糖蛋白存在多位点修饰,47%的糖基化位点可被多种聚糖修饰(图1F-H),提示糖基化修饰的复杂性。驱动基因突变图谱(图1I)揭示高频突变包括:EGFR(51%,符合亚洲人群50%-60%的突变特征)、TP53(19%)、RBM10(17%)及MUC16(17%);值得注意的是,TTN突变率(29%)显著高于既往研究(9%),推测与本研究中浸润前病变占比高(62.1%)相关。
肿瘤突变负荷(TMB)随AIS→MIA→IAC进展呈升高趋势(图1J),虽未达统计学显著性(可能与SSN-LUAD本身的低TMB特性相关),但仍印证了病理演进过程中基因组突变的累积特征,与既往研究结论一致。
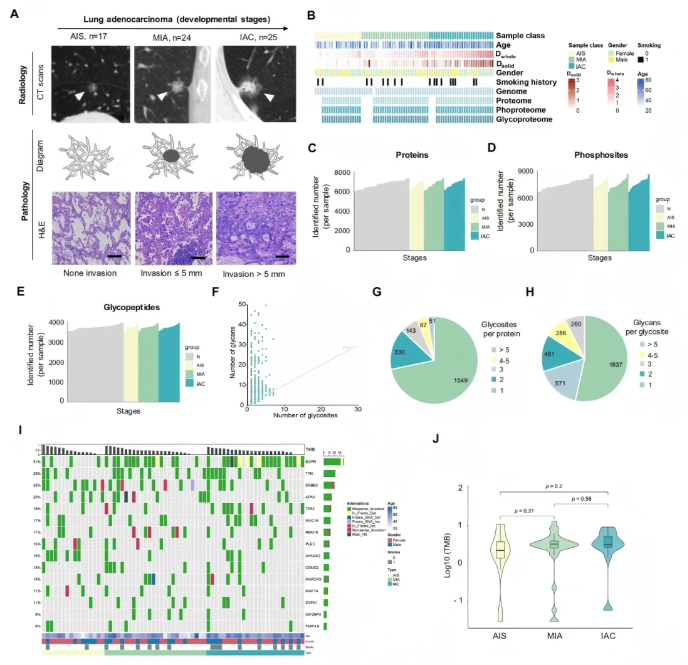
图1. 亚实性结节的蛋白基因组学景观
2、驱动突变与多组学修饰网络的关联机制
通过解析癌症相关基因(CAG)的顺式/反式调控效应,研究在蛋白质组、磷酸化组及糖基化组层面鉴定出10个具有显著调控作用的突变基因。核心发现包括:EGFR突变可降低同源蛋白表达,同时升高其糖蛋白丰度(图2A-C);在EGFR突变肿瘤中,PTPN11/SHP2的酪氨酸磷酸化(Y62/Y542位点)水平显著提升,且这一现象在EGFR突变细胞系(PC-9)中得到验证,与EGFR野生型细胞系(A549、NCI-H226、NCI-H1730)形成明显差异(图2D);此外,EGFR突变显著抑制SUSD2糖蛋白N494位点的糖基化修饰(图2C)。值得注意的是,上述PTPN11磷酸化增强与SUSD2糖基化抑制的协同效应,在从AIS到侵袭性LUAD的进展过程中持续强化(图2E)。
研究提示,糖基化与磷酸化修饰网络的动态失衡是LUAD进展的核心调控枢纽,这为阻断癌前病变向侵袭性肿瘤转化提供了潜在的干预靶点。
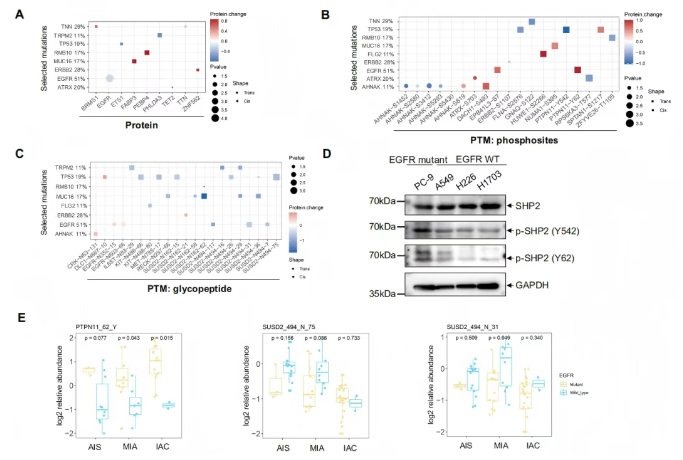
图2. 驱动突变与蛋白质组、磷酸化蛋白质组、糖基化蛋白质组及通路的关联
3、SSN-LUAD多组学分析指导早期检测与治疗干预
研究通过非负矩阵分解(NMF)算法对66例LUAD样本进行多组学聚类,将其分为3个分子亚型(图3A),各亚型呈现显著差异的临床与分子特征:1(癌前型)以女性患者为主,肿瘤直径较小,EGFR突变率高,富集ECM受体相互作用、细胞黏附分子等通路;簇 2主要激活核糖体生物合成、RNA剪接及溶酶体相关通路;簇3(进展型)以男性患者为主,肿瘤直径较大,显著活化细胞凋亡、自噬、铁死亡及糖异生 / 丙酮酸代谢等应激适应性与代谢重编程通路。
聚糖谱亚型特异性分析显示(图3B),簇1富集高甘露糖聚糖,簇2特异性高表达少甘露糖聚糖,簇3则以岩藻糖基化聚糖升高为特征,提示糖基化修饰的亚型特异性可能成为潜在治疗靶点。
为解析糖基化调控机制,研究通过糖肽与糖基化酶的关联分析(图3C)发现,194种糖肽与6种核心糖苷酶(GBA、GUSB、GLA、FUCA1、HEXB、HEXA)存在显著关联。其中,少甘露糖聚糖与上述糖苷酶呈正相关(提示糖苷酶可能促进其生成),而多数糖肽底物与糖苷酶呈负相关(符合酶促降解的常规模式)(图3D)。进一步分析显示,这些糖苷酶的表达水平从簇1到簇3逐步显著上调(图3C),提示针对性抑制此类糖苷酶可能阻断LUAD进展。
针对早期进展的关键驱动事件,研究发现FGFR3的S408磷酸化在AIS阶段特异性高表达(图3E-F),且独立于蛋白水平变化。PC-9细胞模型验证显示,FGFR3-S408磷酸化可通过激活PI3K-AKT-mTOR通路促进细胞增殖,而磷酸化缺陷突变体(S408A)可显著抑制该通路激活及增殖能力(图3G)。此外,通过标准化激酶底物磷酸化丰度评估激酶活性发现,5种已获批抑制剂的激酶(ERK1、ERBB2、SYK、JAK1、CDK6)在簇2和簇3中的活性显著高于簇1(图3H),为亚型特异性治疗提供了候选靶点。
综上,FGFR3-S408磷酸化是驱动LUAD早期进展的关键机制,而糖基化调控及特定激酶活性异常为阻断AIS向侵袭性肿瘤转化提供了新的治疗方向。
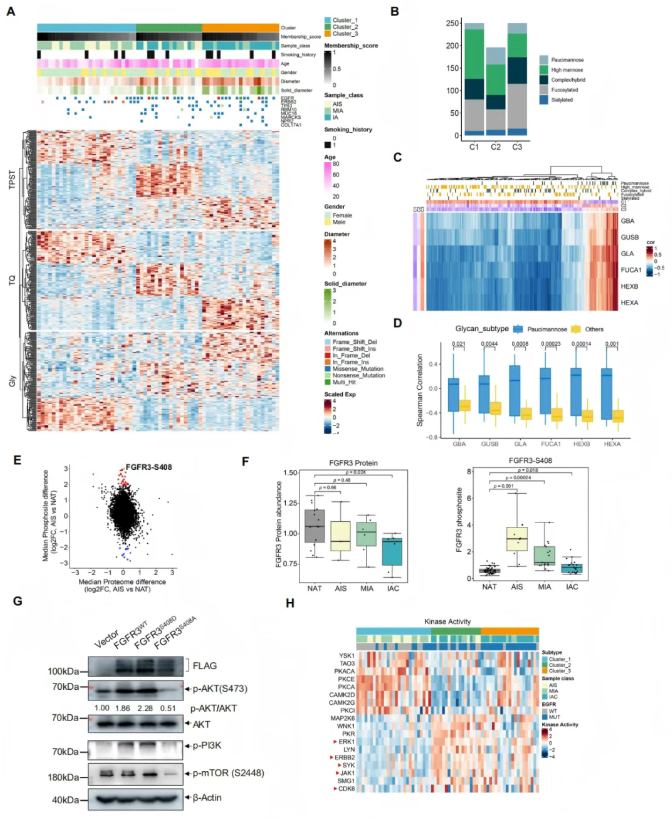
图3. 肺腺癌治疗干预和早期发现的多组学分析
4、蛋白质基因组学揭示胆固醇代谢重编程驱动癌前病变
研究发现,胆固醇代谢紊乱是肺腺癌前驱阶段(AIS)的核心分子事件(图4A-B)。其关键机制为:前蛋白转化酶枯草溶菌素/kexin 9型(PCSK9)通过促进低密度脂蛋白(LDL)受体降解,减少循环中LDL的清除(图4D),进而诱导正常成纤维细胞(HCA2-TERT)发生恶性转化,驱动肿瘤起始微环境的形成(图4C-F)。
Kras突变肺类器官模型验证显示,PCSK9抑制剂(Tafolecimab)可显著促进类器官增殖(数量与体积均增加)(图4K-L),并诱导恶性表型转化——肺表面活性蛋白C(SFTPC)表达降低,上皮细胞黏附分子(EpCAM)、Ki-67及高迁移率族蛋白B1(HMGB1)表达升高(图4N-O)。
万人临床队列(开滦队列,n=109,884)进一步证实,血清总胆固醇水平与肺癌风险呈U型关联:低胆固醇(<160 mg/dl)人群的肺癌风险比(HR)为1.34,高胆固醇(>240 mg/dl)人群的HR为1.45(图4P)。
综上,胆固醇稳态失衡是肺上皮细胞恶性转化的早期驱动力,为肺癌预防提供了代谢干预的新靶点。
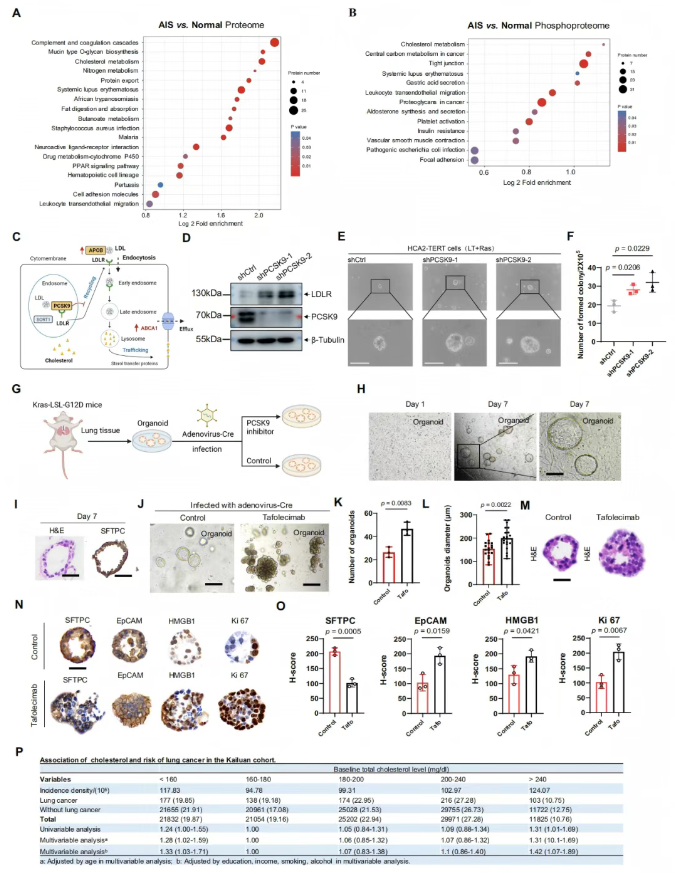
图4. 蛋白质基因组学特征揭示肺癌前病变的肿瘤发生
5、内质网应激是AIS进展至IAC的标志与药物靶点
研究团队对原位腺癌(AIS)、微浸润性腺癌(MIA)及浸润性腺癌(IAC)三个阶段的差异蛋白、磷酸化位点及糖肽进行KEGG通路分析,结果显示:与癌旁组织(NATs)相比,肿瘤组织中黏着斑、内质网(ER)蛋白加工、吞噬体、血小板激活及癌症中的蛋白聚糖通路显著富集(图5A)。由此可见,内质网应激是AIS向 MIA及IAC进展过程中的关键标志。
蛋白质二硫键异构酶(PDI)抑制剂CCF642在三类模型中均展现出显著抑瘤效果:在患者来源的肿瘤异种移植(PDX)模型中,CCF642可显著抑制肿瘤生长并延长小鼠生存期(图5B–F);在17例肺腺癌患者来源的肿瘤类器官(PTC)模型中,CCF642呈浓度依赖性抑制类器官生长(图5G);在Lewis肺癌(LLC)移植瘤模型中,CCF642同样显著抑制肿瘤生长(图5H–J)。体外细胞实验进一步证实,1 μM CCF642可有效抑制LLC细胞增殖(图5K)。
机制研究显示,特异性针对PDI家族成员PDIA3(图5L)可产生强效生长抑制作用(图5M),且该效应与细胞凋亡无关。在LLC移植瘤模型中,沉默PDIA3可显著抑制肿瘤生长并降低瘤重(图5N–P)。综上,CCF642通过增强内质网应激发挥抗肿瘤作用,针对PDI(尤其是PDIA3)可通过强化内质网应激有效阻断肺癌进展。
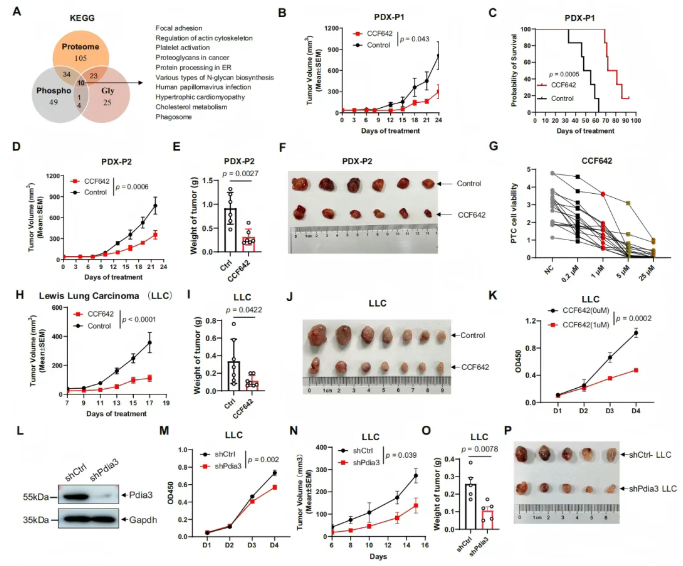
图5. 内质网应激是AIS进展为IAC的标志和药物靶点
基于进展风险将AIS分为:A1亚型:快速进展至MIA/IAC;A2亚型:长期稳定。ER应激作为进展标志物的验证,前期研究证实持续ER应激是AIS向IAC 转化的标志(图5A)。为评估其临床预测价值,影像学动态监测发现A1亚型CT显示肿瘤快速增大(图6A-C),A2亚型保持稳定(图6B)。免疫组化分析,发现A1亚型中ER应激标志物(p-PERK/ATF4/p-eIF2S1)表达显著高于A2亚型(图6D-E),证实ER 应激标志物可预测AIS进展风险。
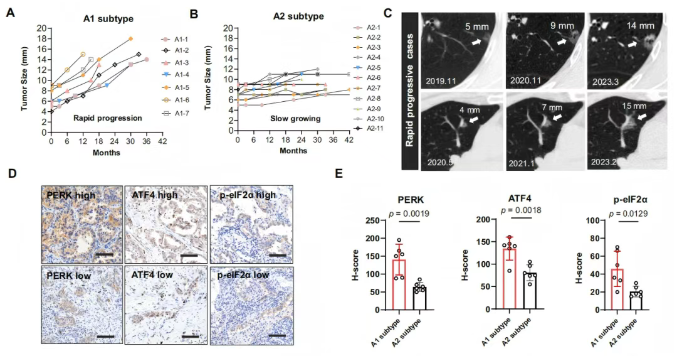
图6. 内质网应激是临床上AIS进展为IAC的标志
研究结论
该研究系统性揭示了肺腺癌从AIS到MIA和IAC的肿瘤发生和进展的分子机制。研究发现胆固醇代谢在AIS阶段的异常上调和内质网应激在肿瘤进展中的持续激活是肺癌发生和进展的关键因素。这些发现不仅为肺癌的早期检测和治疗提供了新的潜在靶点,还为精准医学在肺癌管理中的应用提供了重要的理论基础。
磷酸化修饰蛋白组学:蛋白质磷酸化是由蛋白质激酶催化的把ATP的磷酸基转移到底物蛋白质氨基酸残基(Ser, Thr, Tyr)上的过程,是生物体内一种普通的调节方式,细胞内有超过30%的蛋白质发生磷酸化修饰,在细胞信号转导、调控细胞增殖、发育、分化、凋亡过程中起重要作用。蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。
若您对“磷酸化修饰蛋白组学”等服务感兴趣,百趣生物可提供专业技术服务,欢迎后台私信咨询!









