

英文标题:Unraveling cross-variations in fruit aroma and color during ‘Red Delicious’ bud sport: Insights from targeted metabolomics and transcriptomics
中文标题:‘蛇果’芽变中果实香气与颜色交叉变异的解析:基于靶向代谢组学与转录组学的启示
发表期刊:Food Chemistry
影响因子:9.8
研究背景
在苹果遗传改良中,芽变(Bud sport)是关键的自然突变现象,尤其在‘蛇果’(Red Delicious)中表现显著——该品种是全球产生芽变突变体最多的苹果品种,其性状创新依赖连续芽变。
现有研究已揭示芽变对果皮颜色的分子机制,但对芽变过程中香气成分(如酯类、醇类、萜类等挥发性化合物)的动态变化及基因调控网络仍缺乏系统解析。
值得注意的是,香气作为苹果风味的核心组成,其合成途径(脂肪酸代谢、氨基酸替代、萜类及苯丙烯类合成)与颜色调控的苯丙烷类途径共享关键前体,暗示两者可能存在协同调控。
目前,跨物种研究已证实芽变可同时影响颜色与香气:如葡萄芽变中VvAADC基因表达上调导致香气前体积累,月季中的MYB5转录因子同时调控单萜类与原花青素合成,桃子中NAC转录因子PpBL通过调控PpMYB10.1和PpNAC1影响果肉颜色与香气。
为填补苹果芽变香气调控的空白,本研究以‘蛇果’及其四个连续芽变突变体(‘Starking Red’、‘Starkrimson’、‘Red Chief’、‘Oregon Spur II’)为材料,结合GC-MS定量分析果皮中花青素与挥发性化合物,通过转录组学解析功能基因表达,并利用多组学整合与WGCNA分析,揭示芽变中颜色与香气的协同调控机制。
研究结果
01.‘蛇果’及其四个连续芽变突变体的综合表型与分子特征
按照果皮颜色的表型变化,‘蛇果’及其四个连续芽变突变体的成熟果皮组织可明确分为Y(部分红色+纵向条纹)、L/X(纵向条纹过渡到完全红色)、S/E(完全红色)五组,存在明显外观差异(图1A)。
此外,结合主成分分析(图1B-D)和层次聚类(图1E-G),五组样本差异显著,均能被独立分成五类,与果皮颜色表型分组一致(图1A),揭示芽变过程中果皮颜色与香气成分的变异与整体基因表达高度平行且相关。
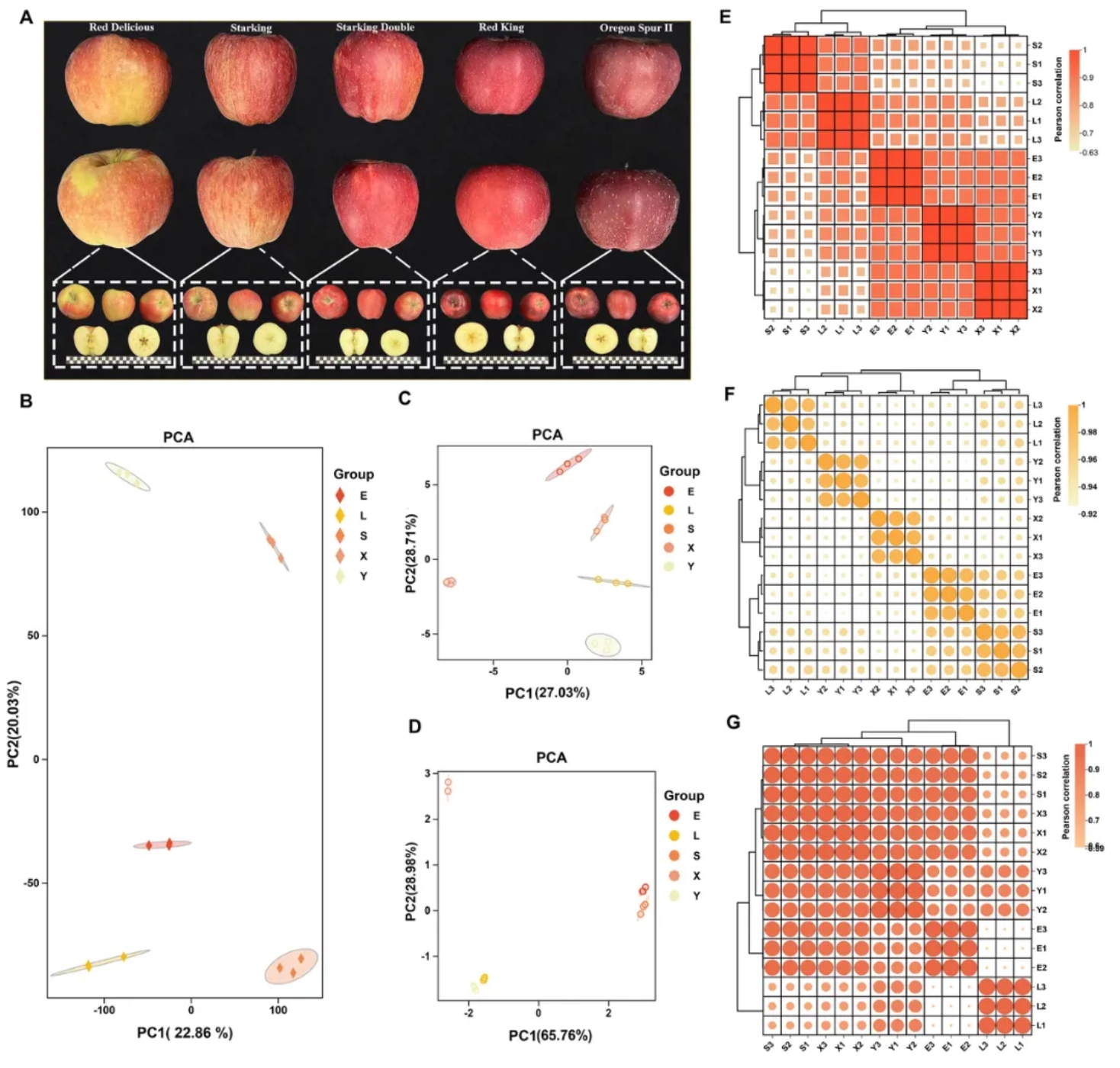
图 1 代谢组和转录组数据摘要
02.苹果芽变过程中花青素与挥发性物质代谢途径中生物活性物质的变化
在代谢物鉴定与分类方面,总计1455种挥发性代谢物和110种花青素代谢物被鉴定。
其中,芽变突变体(L、X、S、E组)相较于Y组(对照),上调的挥发性代谢物以有机酸及衍生物为主(图2A-B),下调的挥发性代谢物则主要集中在脂质及脂质类似分子类别,而这些酯类衍生物水平的改变或许与成熟苹果香气强度的降低有关(图2A-B)。
此外,相比于Y组,总计37种花青素代谢物在其他芽变突变体(L、X、S和E组)中表现出≥2倍的丰度变化,其中23种上调,14种下调(图2A-B)。
进一步结合相关途径化合物的变化趋势来看,可以得知,‘蛇果’芽变过程主要通过影响黄酮类和花青素的生物合成途径来调控果实颜色变化。
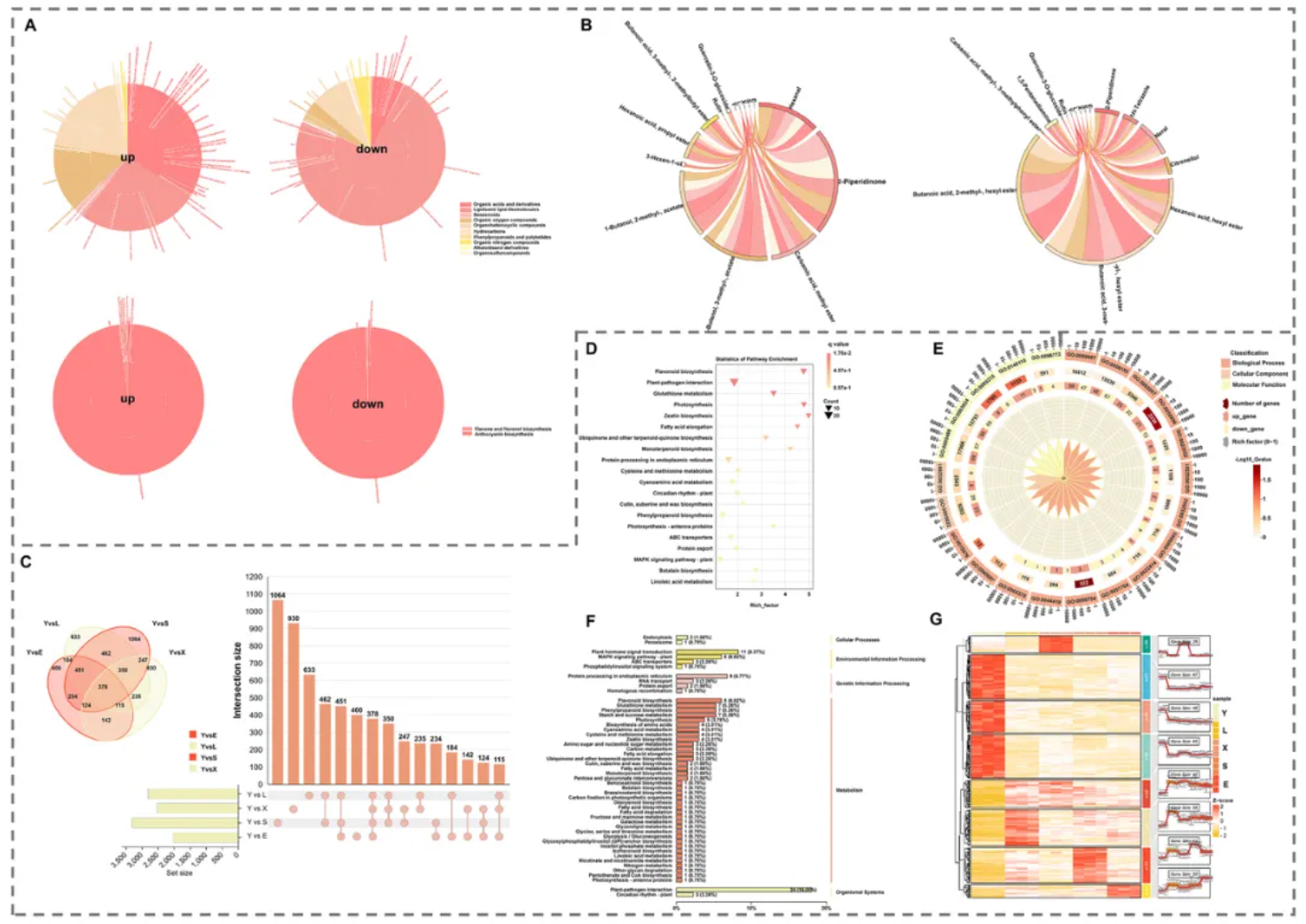
图 2 ‘蛇果’芽变过程中关键代谢物与转录组数据的动态变化分析
03.‘蛇果’芽变过程的转录组分析
借由转录组数据分析,通过与Y组(对照)比较,在L、X、S、E组(芽变突变体)中,分别鉴定出2808、2521、3310和2028个差异表达基因(DEGs)(图2C)。
根据基因功能富集分析,这些DEGs主要富集于黄酮类生物合成(占主导)、脂肪酸延长、萜类生物合成及亚油酸代谢等生物过程(图2D),暗示着黄酮类生物合成与挥发性物质调控的关联。此外,部分氨基酸生物合成代谢也可能在‘蛇果’芽变过程中对挥发性物质的变化具有调控作用(图2F)。
GO分类富集分析显示,在分子功能、生物过程和细胞组分三个维度中,生物过程在三组比较中均占据主导地位(图2E)。
总体而言,在‘蛇果’芽变过程中,黄酮类生物合成可能主要参与花青素的合成,而萜类生物合成、脂肪酸代谢及亚油酸代谢可能活跃于挥发性物质的合成调控中(图2D-F)。
04.DEGs的模块化分析
如图2G所示,所有DEGs可根据表达动态分为三组(Group I:上调;Group II:下调;Group III:S组中表达最高),反映了芽变过程中基因表达的复杂调控模式。
通过K-means聚类分析,这些DEGs被划分为18个模块(Group 1-Group 18)(图3A)。
为明确这些模块中DEGs的潜在功能,GO气泡图和KEGG分类图被用于富集分析。
结果显示,Group 8中的大多数DEGs主要富集于黄酮类生物合成途径(图3B);Group 14中的DEGs主要富集于淀粉和蔗糖代谢途径,同时部分基因涉及萜类生物合成和脂肪酸代谢(图3C);Group 2和Group 10中的DEGs富集模式相似,主要涉及氨基糖与核苷酸糖代谢及脂肪酸代谢途径(图3D-E)。
此外,在果实颜色和香气相关的四个关键TF家族(WRKY、MYB、NAC、bHLH)中,总计54个转录因子(TFs)被筛选鉴定(图3F),其中大多数在芽变组中表达下调(图3B)。
由此推测,上调的TFs可能通过激活花青素合成基因,促进果实颜色变化;下调的TFs可能通过抑制脂肪酸代谢基因,导致香气相关酯类物质减少(图3B-F)。
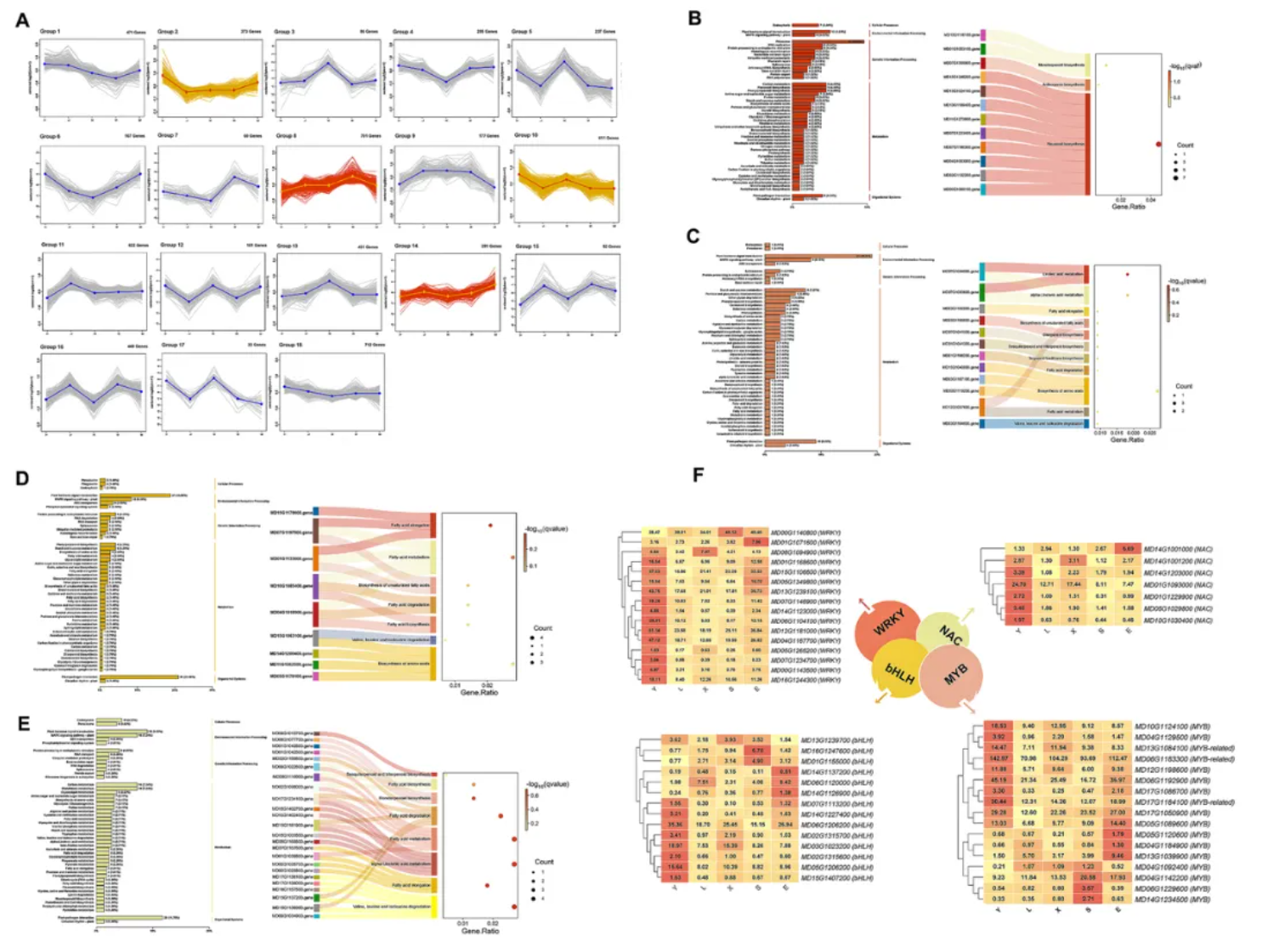
图 3 差异表达基因的模块分析
05.转录组与代谢组的联合分析
为探索‘蛇果’芽变过程中果实颜色与香气变化的分子机制,转录组和代谢组联合分析被用于后续实验,
其主要结果如下:
在‘蛇果’芽变过程中,酮类生物合成、萜类生物合成、脂肪酸代谢及α-亚油酸代谢通路显著富集(图4A-D)。
花青素合成核心基因(如MdUFGT、MdCHS、MdANS)与特定花青素代谢物呈强正相关(图4E),暗示着这些基因驱动果实颜色变化的可能性
α-亚油酸代谢通路中的MdLOX基因与3-Hexen-1-ol呈强正相关(图4A-D),强调了其与芽变果实中木质香气的关联性。
萜类生物合成关键基因MdDXS和MdGPPS与多种挥发性香气成分呈正相关(图4F),揭示芽变过程中萜类代谢对香气多样性的贡献。
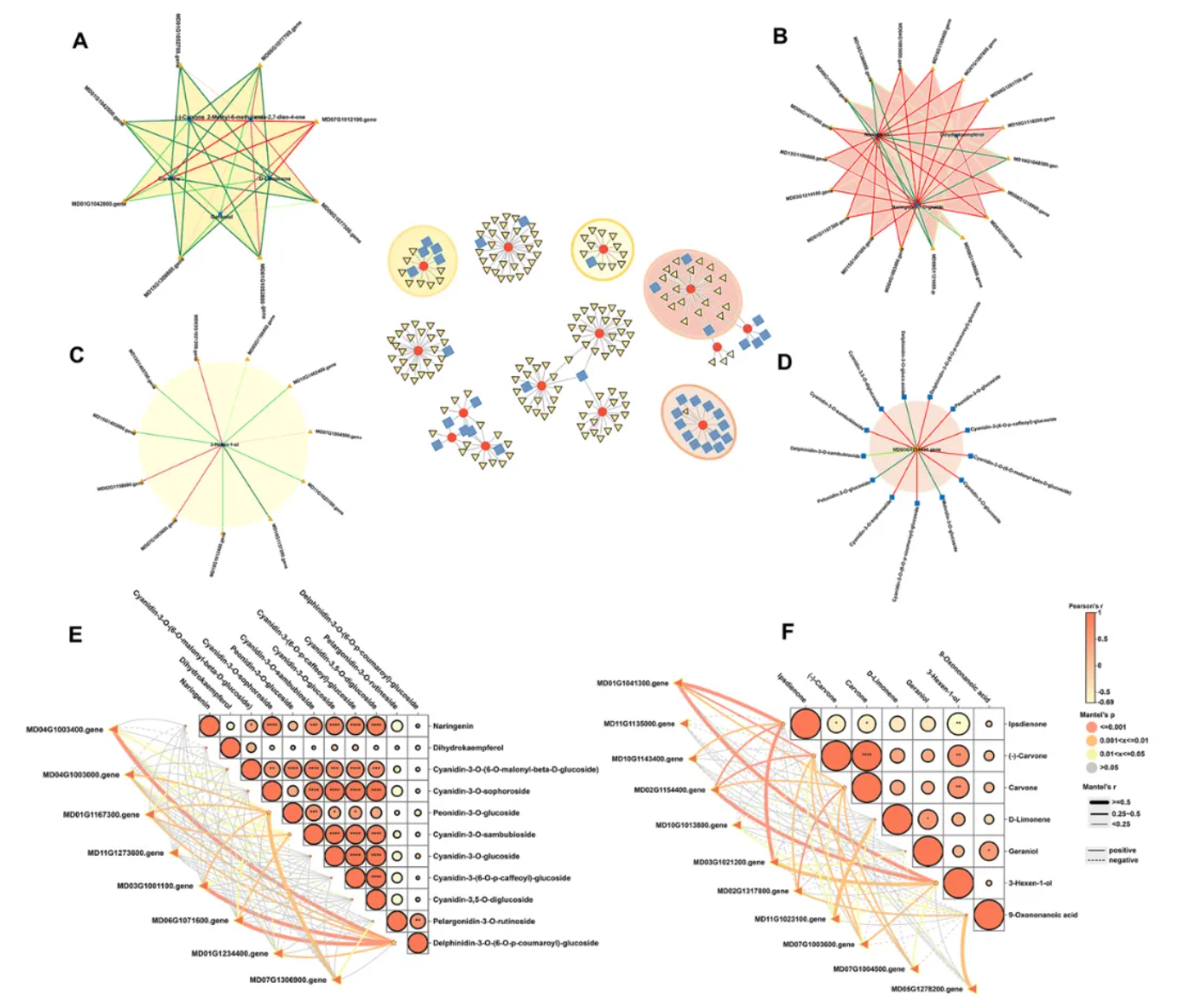
图 4 联合转录组和代谢组分析
06.‘蛇果’芽变过程中主要调控果实颜色与香气的代谢通路中基因与代谢物的表达模式
基于上述结果,结合Kgml分析,进一步明确“黄酮类生物合成、萜类生物合成及α-亚油酸代谢”是调控‘蛇果’芽变过程中果实颜色与香气变化的核心通路(图5)。
聚焦花青素生物合成途径,总计9个关键基因(包括CHS、ANS、UFGT和CHI)在芽变过程中的表达显著上调;同时,相关花青素合成代谢物也与这些基因的表达趋势一致,强调了这些基因驱动果实颜色变化的可能性(图5)。
此外,部分挥发性物质(如3-Hexen-1-ol)在芽变组中显著积累,而α-亚油酸代谢通路中的多数基因(如MdLOX)在芽变组中上调,可能促进了酯类挥发性物质的合成。值得注意的是,磷脂酶A1和MdLOX在芽变组中下调,或许与酯类挥发性物质的减少相关(图5)。
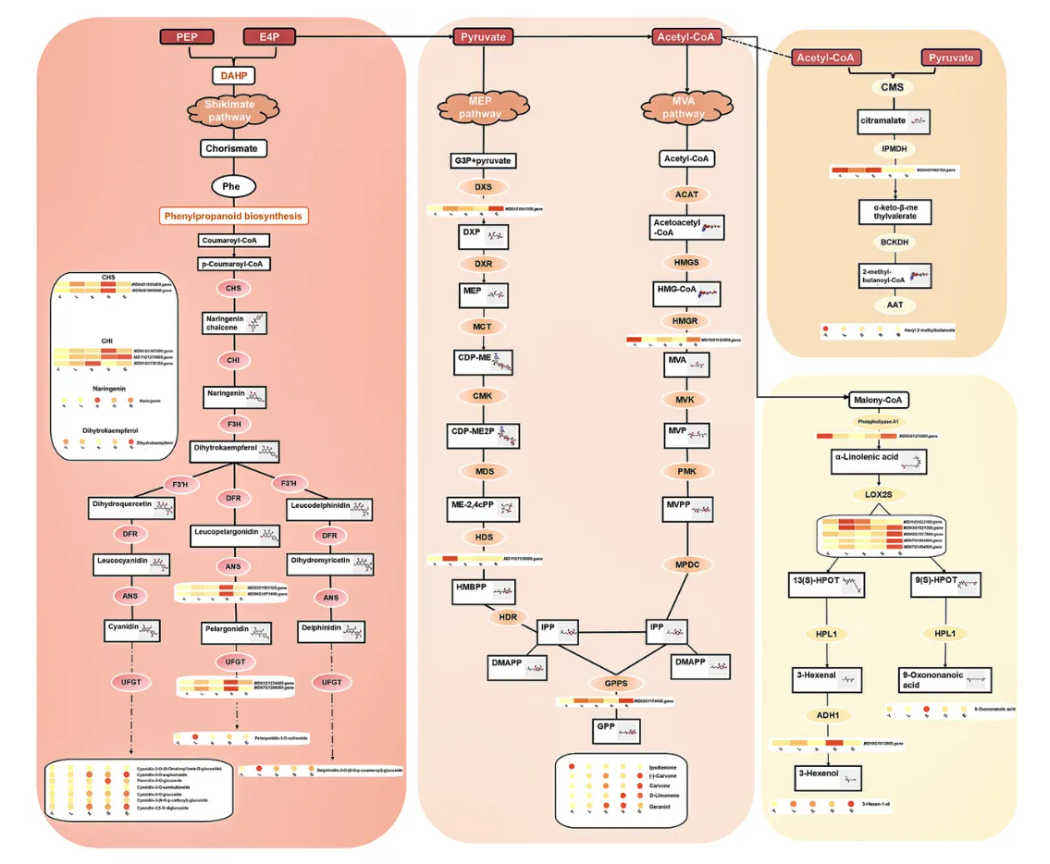
图 5 ‘蛇果’芽变过程中不同代谢通路的差异表达基因与差异积累代谢物鉴定
有趣的是,在图5所展示的代谢通路中,萜类代谢前体(如Acetyl-CoA和Pyruvate)在柠檬醛合酶作用下生成柠檬醛,进而通过不同酶转化为酯类化合物(如Hexyl 2-methylbutanoate)。
然而,在芽变过程中,Hexyl 2-methylbutanoate的含量却显著下降,而这可能与3-异丙基苹果酸脱氢酶(MD04G1062100)基因表达降低有关,表明萜类合成通路的关键基因调控对果实香气有重要影响(图5)。
另外,MEP通路中的DXS和MVA通路中的HMGR等基因在芽变过程中被激活,可能由此促进挥发性化合物(如香叶醇、香芹酮)的生成,而HMGR基因也与Ipsdienone的表达模式一致,亦进一步支持其在香气调控中的作用(图5)。
07.与挥发性物质和花青素代谢相关的WGCNA模块鉴定
为解析‘蛇果’芽变过程中调控挥发性物质与花青素生物合成的网络关系,加权基因共表达网络分析(WGCNA)被用于后续研究。
在WGCNA分析中,总计8个基因共表达模块被鉴定。其中,MEpink模块与多数花青素合成代谢物呈高度显著正相关,同时也与部分萜类生物合成代谢物呈正相关;MEgreen模块则与萜类生物合成关键代谢物及亚油酸代谢通路代谢物强正相关(图6A-B)。
对于MEpink模块,总计6个花青素合成相关结构基因被筛选,并存在5个可能的转录因子能够通过调控其表达,进而影响花青素关键代谢物的积累(图6C-F)。
另外,在MEgreen模块中,也存在着5个转录因子与α-亚油酸代谢关键基因MdLOX(MD02G1317800)呈正相关,它们可能调控MdLOX基因,从而参与挥发性物质(如3-Hexen-1-ol)的代谢(图6F-G)。
综上所述,MEpink和MEgreen模块均与‘蛇果’芽变过程中果实颜色与香气变化的关键代谢物(如花青素和挥发性酯类)紧密关联,且表现出一致的正相关性,表明这两个模块可作为解析芽变调控机制的核心靶标(图6A-G)。
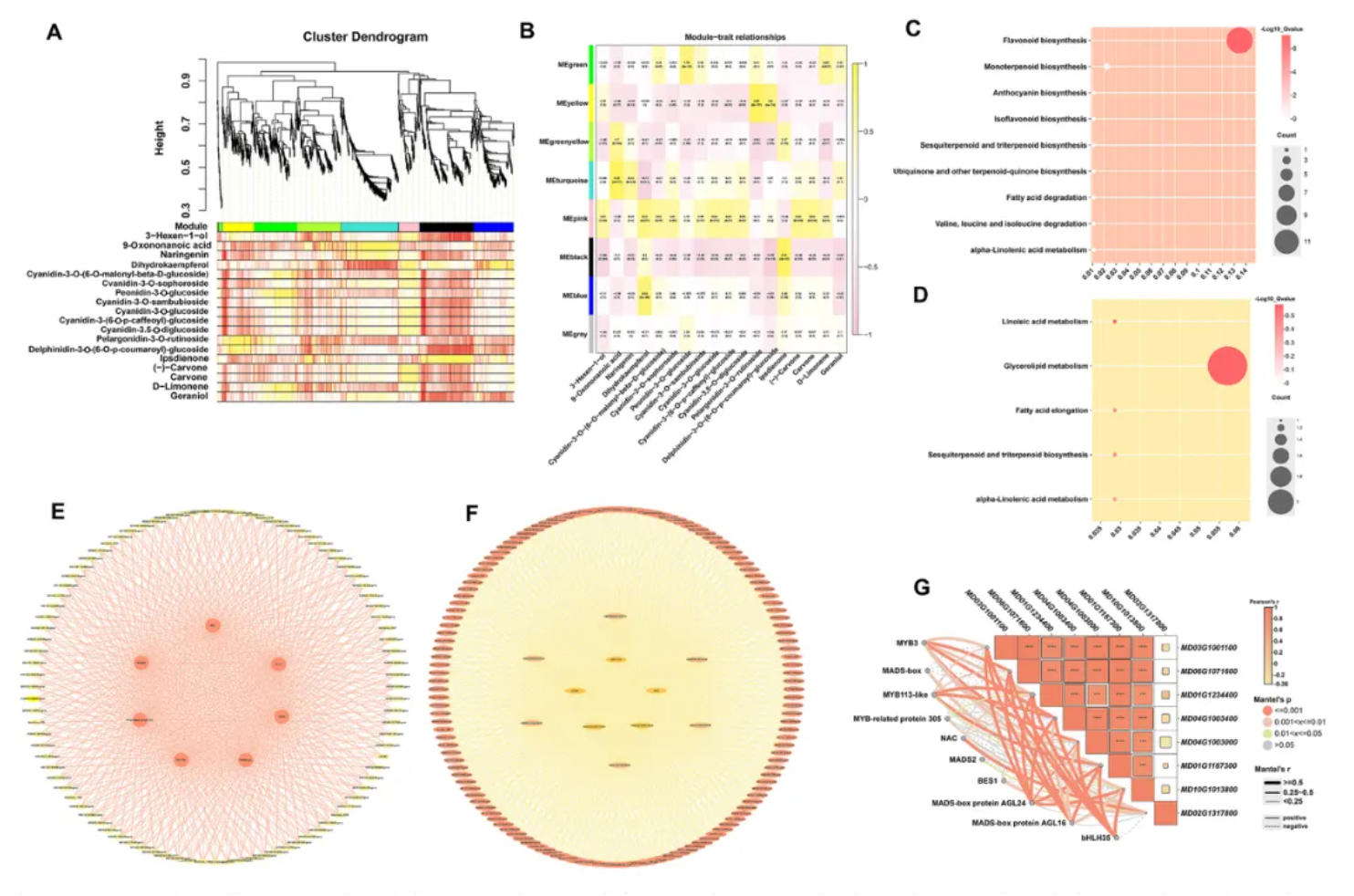
图 6 关键基因和代谢化合物的WGCNA分析
08.qRT-PCR验证基因表达谱
为验证RNA-seq中富集通路的DEGs表达模式,多个关键基因被筛选用于qRT-PCR实验中,其中包括花青素合成的结构基因(如CHS、CHI、ANS)以及挥发性物质合成的关键基因(如DXS、LOX、HMGR)等。
结果显示,这些关键基因的qRT-PCR表达趋势同样与RNA-seq结果一致(图7)。
因此,转录组数据的准确性与可重复性得到验证,也进一步表明这些基因在芽变过程中对香气成分的调控作用具有可靠性。
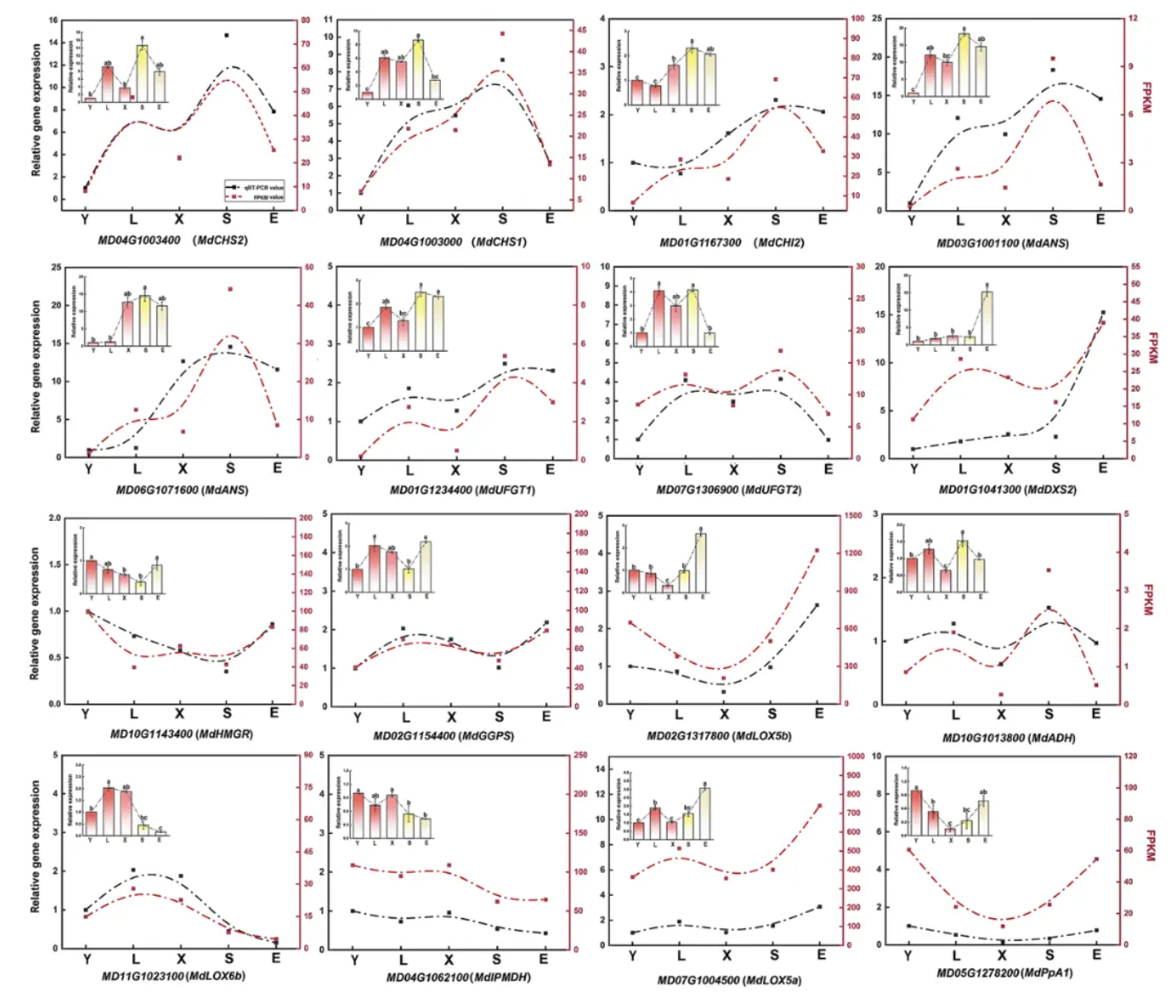
图 7 使用qRT-PCR验证候选基因
09.‘蛇果’芽变过程中果实香气与颜色的交叉变异
基于转录组与代谢组整合分析,‘蛇果’芽变过程中果实香气与颜色交叉变异的调控模型被首次建立(图8)。
简而言之,芽变果实芳香强度的下降主要由挥发性酯类及萜类物质的代谢失衡驱动所致;在α-亚油酸代谢通路中,MdLOX与MdADH基因的上调可能通过促进3-Hexen-1-ol的积累,增强木质香型;MdIPMDH基因的下调直接导致Hexyl 2-methylbutanoate含量减少,削弱果香特征;生物前体丙酮酸与乙酰辅酶A在MdGPPS与MdDXS基因的调控下,优先用于萜类物质的合成,间接抑制了挥发性酯类的生成(图8、图5)。
此外,成熟果皮从垂直红色条纹转变为完全暗红色,与花青素合成结构基因(MdCHI、MdCHS、MdANS、MdUFGT)的上调密切相关,即这些基因的上调时,可能通过促进关键花青素代谢物的积累,进而驱动果实颜色的显著变化(图8)。
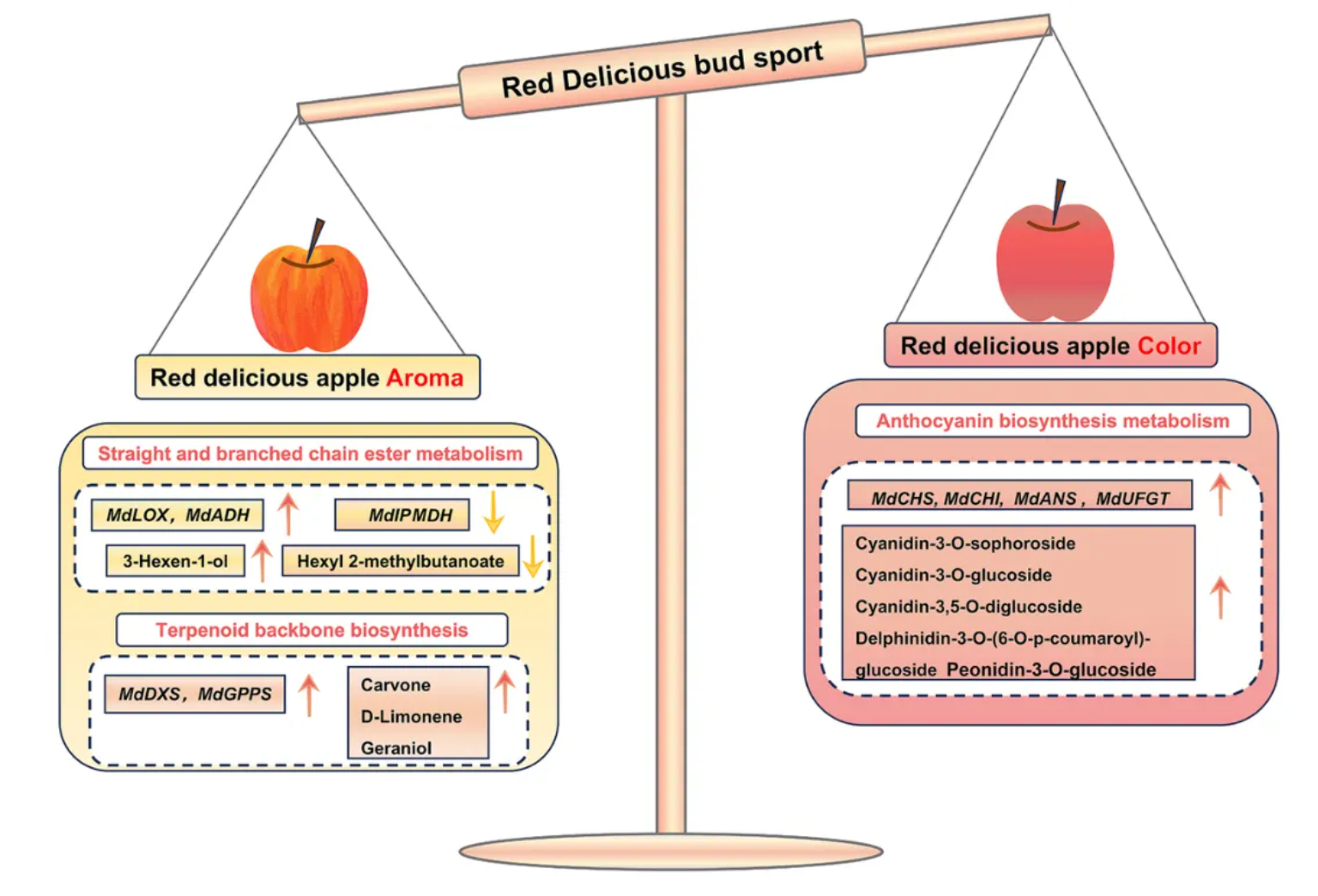
图 8 ‘蛇果’芽变过程中果实香气与颜色的交叉变异模型
研究小结
本研究首次系统揭示了‘蛇果’芽变过程中果实色泽与香气的交叉调控机制。
其主要结果如下:
果皮由条纹状向均匀暗红色转变,与Cyanidin-3,5-O-diglucoside等关键花青素代谢物的积累密切相关,其合成受9个结构基因(如MdCHI、MdCHS、MdANS、MdUFGT)的调控。
芽变果实芳香强度的显著降低,主要源于挥发性酯类化合物的合成减少(与MdIPMDH基因下调相关),以及3-Hexen-1-ol的积累增加(受MdLOX与MdADH基因上调驱动)。
筛选出与深色化及香气降低相关的候选基因与12个转录因子,并揭示它们在维持苹果外观与内在品质平衡中的潜在作用。综上,这些结果为解析苹果色泽与香气的复杂互作关系提供了崭新视角,为后续品种改良、品质提升奠定理论基础。
百趣生物花青素高通量靶标定量产品,专注于花青素单体检测。该产品可检测 14 种常见花青素及相关物质,还支持个性化定制。采用 Thermo Q Exactive 高分辨质谱,定性定量准、灵敏度高,能提供同批次标曲、每种化合物的标准曲线与色谱图,人工核验减少偏差,“一物一法” 个性化检测,适用于园艺植物呈色机理、植物抗逆等多领域研究。









