

英文标题:Ferroptosis-induced SUMO2 lactylation counteracts ferroptosis by enhancing ACSL4 degradation in lung adenocarcinoma
发表期刊:Cell Discovery
影响因子:12.5
客户单位:复旦大学附属中山医院
百趣提供服务:定量脂质组学
研究背景
肺癌为全球癌症死亡首因,约 85% 为非小细胞肺癌,肺腺癌(LUAD)最常见,患者五年生存率不足 26%。肿瘤有氧时仍依赖糖酵解(代谢重编程),导致乳酸(LA)大量积聚。LA 既促肿瘤进展与耐药,又介导赖氨酸乳酸化(Kla)这一新型翻译后修饰,但非组蛋白乳酸化在LUAD中的作用待阐明。
铁死亡是依赖脂质过氧化的调控性死亡,可逆转放化疗及免疫耐受;其发生时线粒体受损,癌细胞更依赖糖酵解致 LA 升高,且已知 LA 可抑制铁死亡,但其通过乳酸化调控该过程的机制不明。
本研究发现:铁死亡诱导 LUAD 细胞 LA 堆积并增强蛋白乳酸化,其中 SUMO2 第 11 位赖氨酸乳酸化(SUMO2-K11la)上调最突出;该修饰阻碍 ACSL4 的 SUMO 化,促其泛素-蛋白酶体降解,削弱脂质过氧化,使 LUAD 获铁死亡抵抗。
研究者据此设计靶向 SUMO2-K11la 的细胞穿透肽(CPP),在患者来源类器官、LUAD 异种移植及自发性肺癌模型中证实:其可竞争性抑制该乳酸化、恢复 ACSL4 水平,显著增敏铁死亡并协同化疗与免疫治疗,为 LUAD 提供新策略。
技术路线
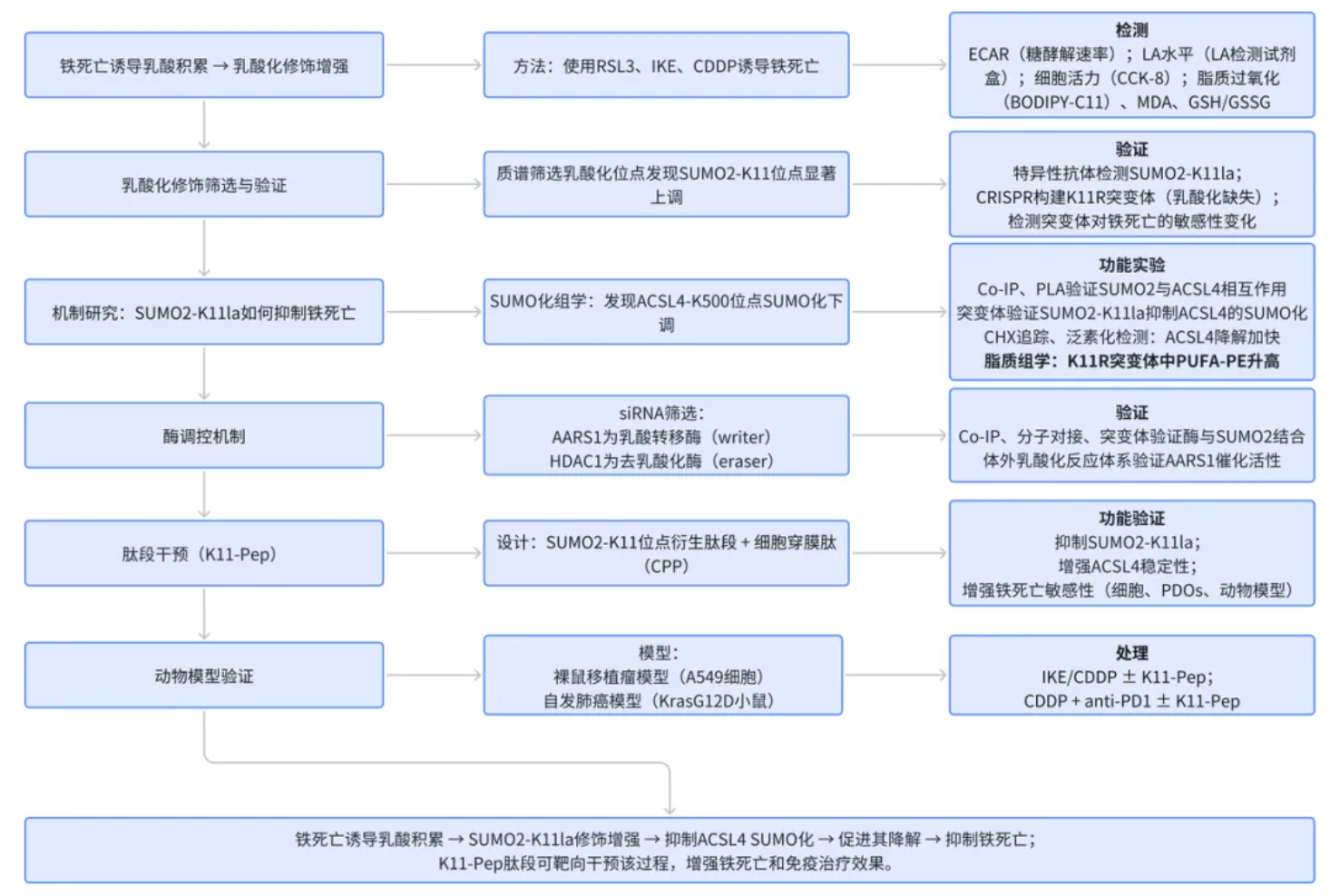
研究结果
01.铁死亡诱导的 LA 产生有助于铁死亡抗性
为系统解析铁死亡相关代谢,研究者联合代谢物库筛选与非靶标代谢组学(图1a-c),锁定乳酸(LA)与肌氨酸为关键差异代谢物(图1d)。
RNA-seq、Seahorse 及 LA 检测显示,RSL3、IKE 或 CDDP 诱导铁死亡后,糖酵解基因富集、ECAR 升高、LA 大量积聚(图1e-f);细胞可能通过代偿性糖酵解维持 ATP 并减轻 ROS。
功能实验表明:LA、H⁺及 NALA 均能抑制铁死亡诱导剂(FINs)诱导的铁死亡(图1g),其中 NALA 显著降低脂质 ROS 和 MDA,提高 GSH/GSSG 比值,证实乳酸阴离子具有抗铁死亡活性(图1j)。
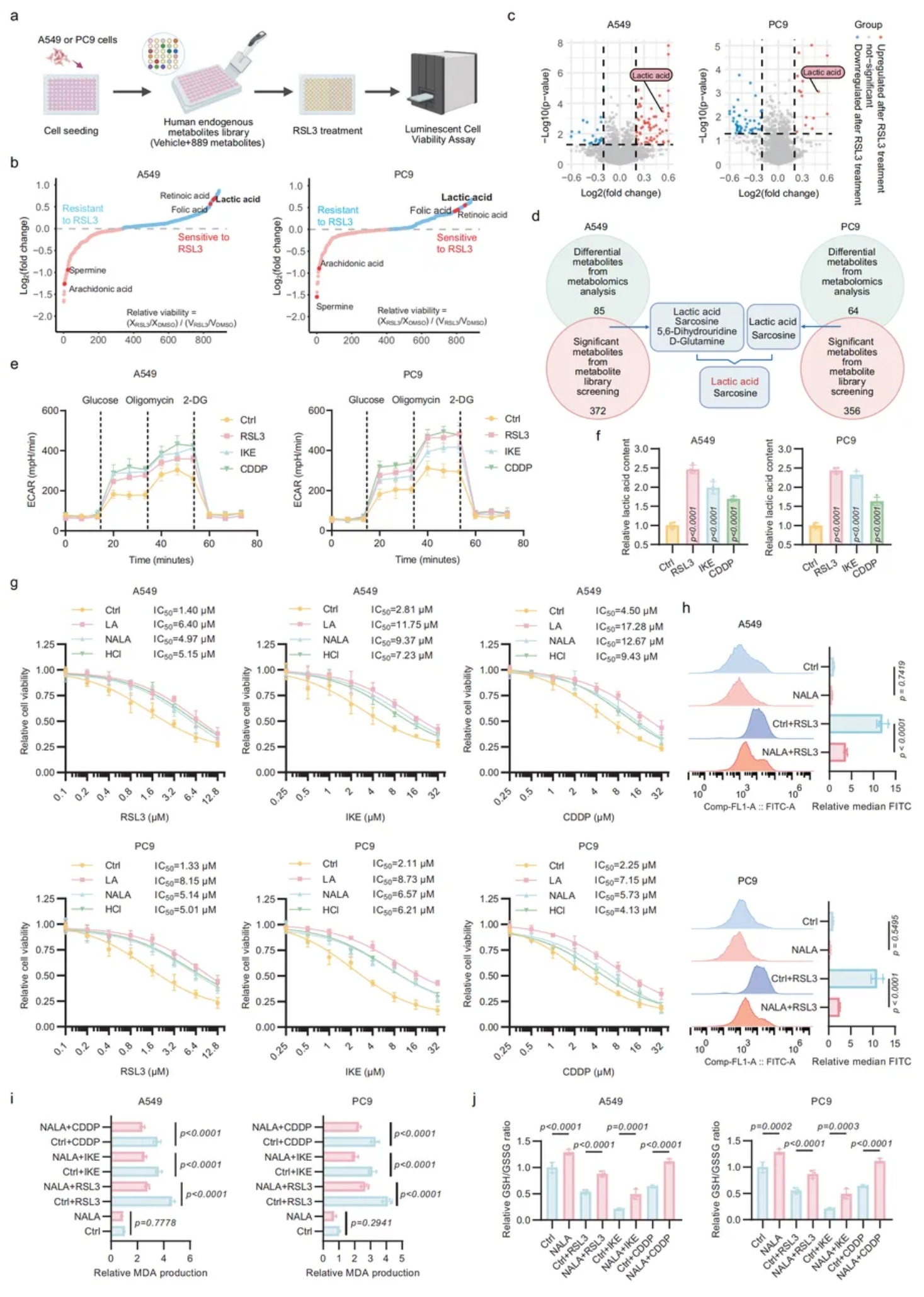
图1. 铁死亡诱导的乳酸生成有助于铁死亡抵抗
02.铁死亡诱导SUMO2在赖氨酸(K)-11位点的乳酸化
考虑到乳酸阴离子与乳酸化密切相关,本文探讨了乳酸化与铁死亡之间的联系。铁死亡诱导剂RSL3、IKE或CDDP处理后,LUAD细胞总蛋白乳酸化显著升高(图2a)。
质谱筛查发现SUMO2-K11位点乳酸化(SUMO2-K11la)增幅最突出(图2b-c);该修饰已在NSCLC与肝癌乳酸组数据中出现,但功能未知。
K11跨物种保守,TCGA提示SUMO2与应激反应相关。Co-IP证实铁死亡仅提高SUMO2的L-乳酸化,而不改变其表达(图2d)。
随后,定制抗体特异性识别SUMO2-K11la(图2e-f)。利用CRISPR/cas9介导的基因编辑技术构建K11R突变株(图2g-h),NALA可提升SUMO2-K11la水平,草酸钠及2-DG则降低SUMO2-K11la水平,而K11R突变株中SUMO2-K11la信号完全消失,证实抗体与修饰特异性(图2i)。
环己亚胺(CHX)追踪实验表明,SUMO2-k11la不影响SUMO2蛋白的稳定性(图2k)。此外,在K11乳酸化后,SUMO2亚细胞分布没有明显变化(图2l)。
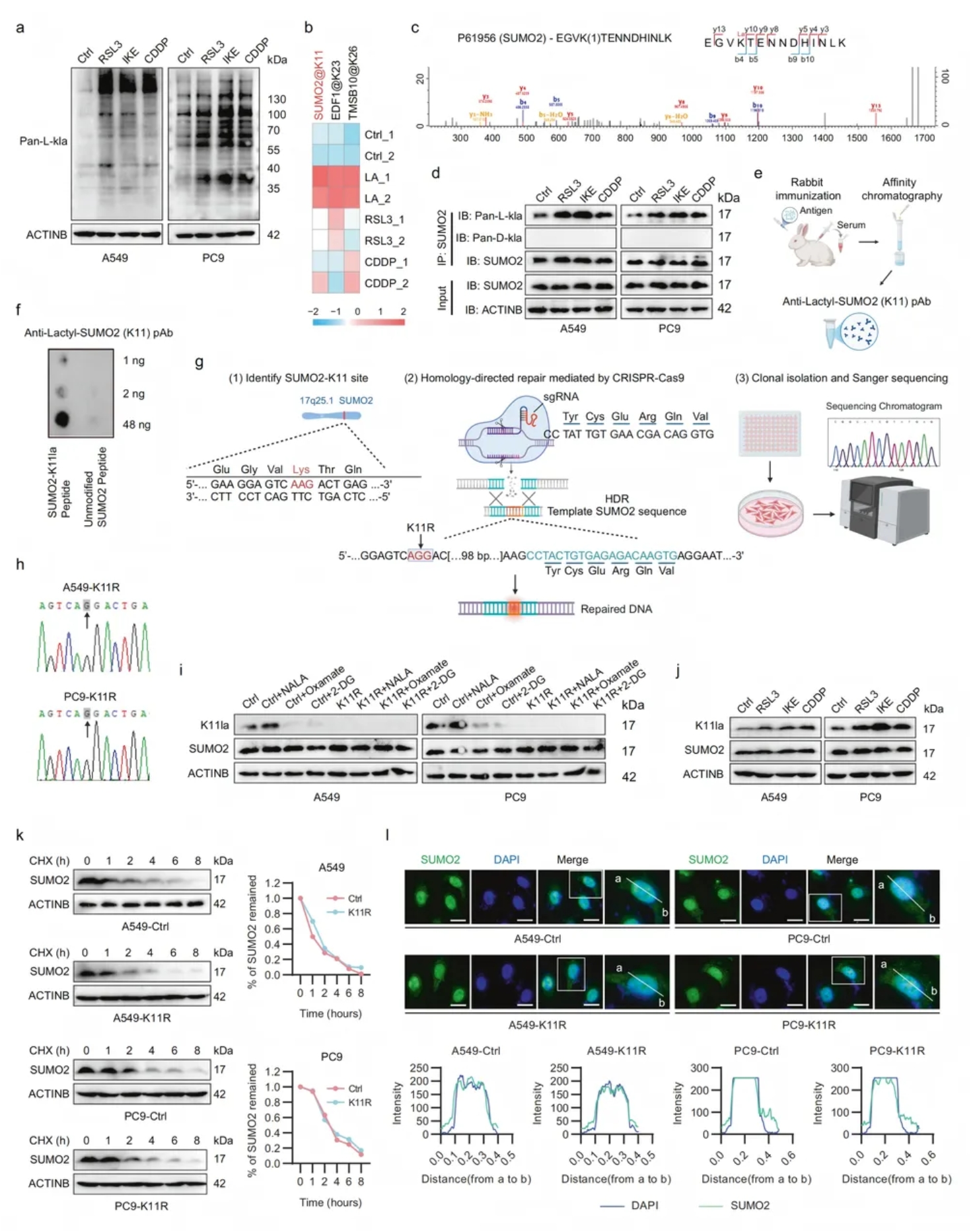
图2. 铁死亡诱导SUMO2在赖氨酸(K)-11位点的乳酸化
03.SUMO2-K11la可对抗LUAD中的铁死亡
为了测试SUMO2-K11la对铁死亡的影响,进行了细胞毒性试验,结果表明,与对照组(Ctrl)相比,引入K11突变对铁死亡的敏感性更高(图3a-b),凋亡或坏死抑制剂无挽救作用,而 DFO、Ferrostatin-1可完全阻断死亡,证实铁死亡为唯一途径;IC50测定亦表明K11R降低FIN耐受,NALA仅对野生型有效(图3c)。
脂质ROS、MDA升高,GSH/GSSG下降(图3e-f),电镜见线粒体嵴断裂,均提示SUMO2-K11la抑制铁死亡(图3g-h)。
对140例LUAD组织进行免疫组化(IHC)染色,高SUMO2-K11la对应脂质过氧化标志物4-HNE减少(图3i-j),且患者总生存及术后化疗预后更差,故该修饰可作为预测LUAD疗效与结局的新生物标志物。
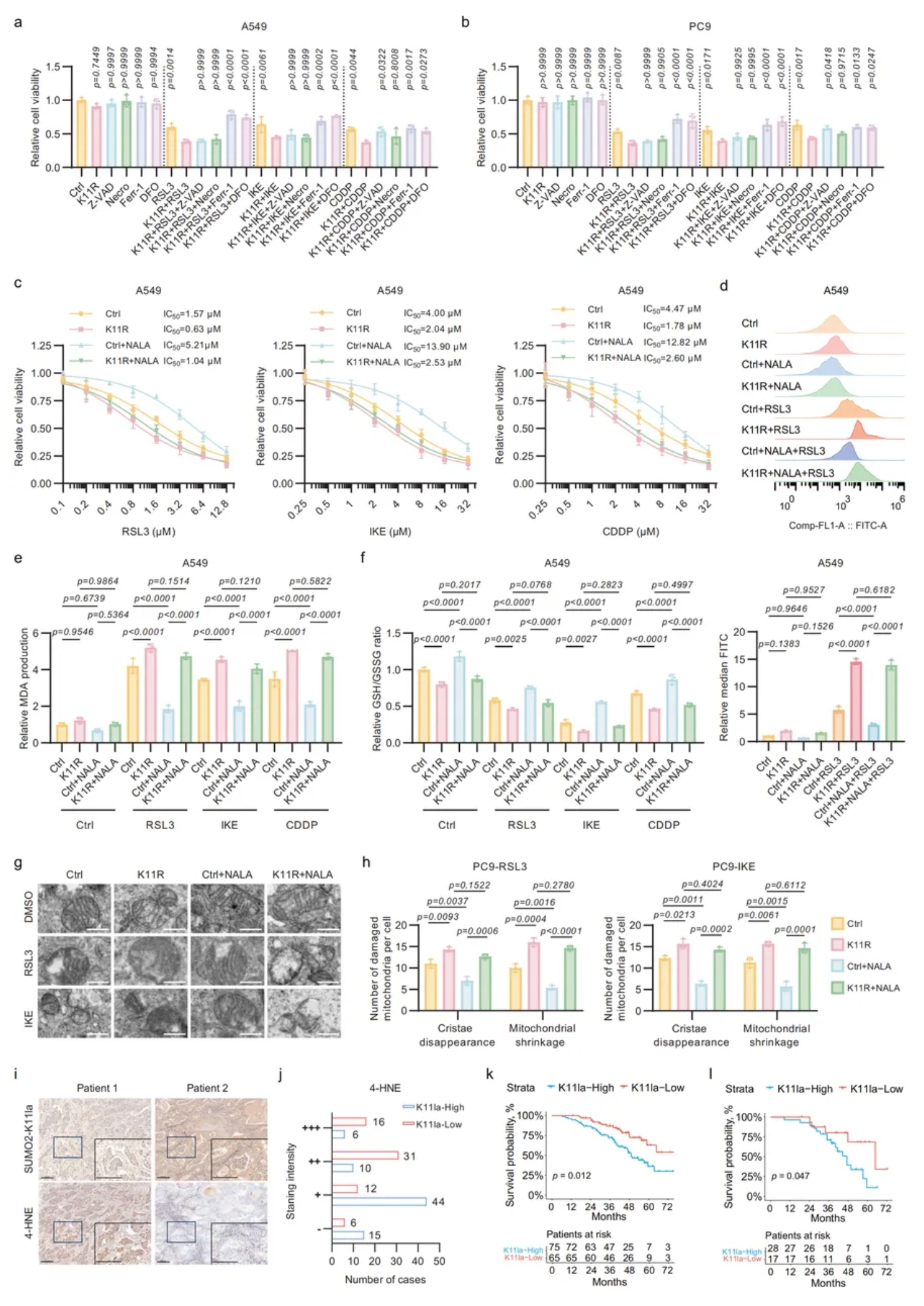
图3. SUMO2-K11la可对抗LUAD中的铁死亡
04.SUMO2-K11la阻碍ACSL4在K500位点的SUM化修饰,从而促进ACSL4的降解
由于SUMO2是SUMO化的主要贡献者,因此研究了K11la 对LUAD细胞SUMO化的影响。4D无标记定量蛋白质组学结果显示,RSL3诱导铁死亡后ACSL4-K500位点SUMO化显著丢失(图4a-b)。
GPS预测与共聚焦证实该位点存在且与SUMO2共定位。PLA表明SUMO2-K11R突变增强两者结合(图4c),而NALA或FINs减少ACSL4的SUMO2/3修饰,草酸钠则相反;K11R突变取消上述调控并使ACSL4过度SUMO化,证实SUMO2-K11la负向调控SUMO2-ACSL4相互作用(图4d-e)。
鉴于ACSL4参与PUFA向PUFA-CoA的转化,研究者进行了脂质组学分析,以评估K11R突变对脂质代谢的影响,结果显示,K11R突变致ACSL4底物PE-AdA与PE-AA蓄积(图 4f)。CHX实验表明,NALA/FIN加速ACSL4降解,该效应可被MG132逆转,而草酸钠或K11R突变抑制降解(图 4g);泛素化检测证实NALA/FIN及SUMO2敲除促进ACSL4泛素化,草酸钠则抑制(图4h)。
因此,SUMO2-K11la通过阻断ACSL4-SUMO化、增强其泛素-蛋白酶体降解,导致ACSL4不稳定。
构建ACSL4-K500R单突变和SUMO2-K11R/ACSL4-K500R 双突变LUAD细胞。K500R取消ACSL4-SUMO化,促其泛素降解,并逆转SUMO2-K11R对ACSL4的稳定效应;双突变亦消除K11R赋予的铁死亡抗性,细胞毒性、脂质过氧化及氧化还原失衡均恢复,证实K500 SUMO化是该轴关键开关(图5)。
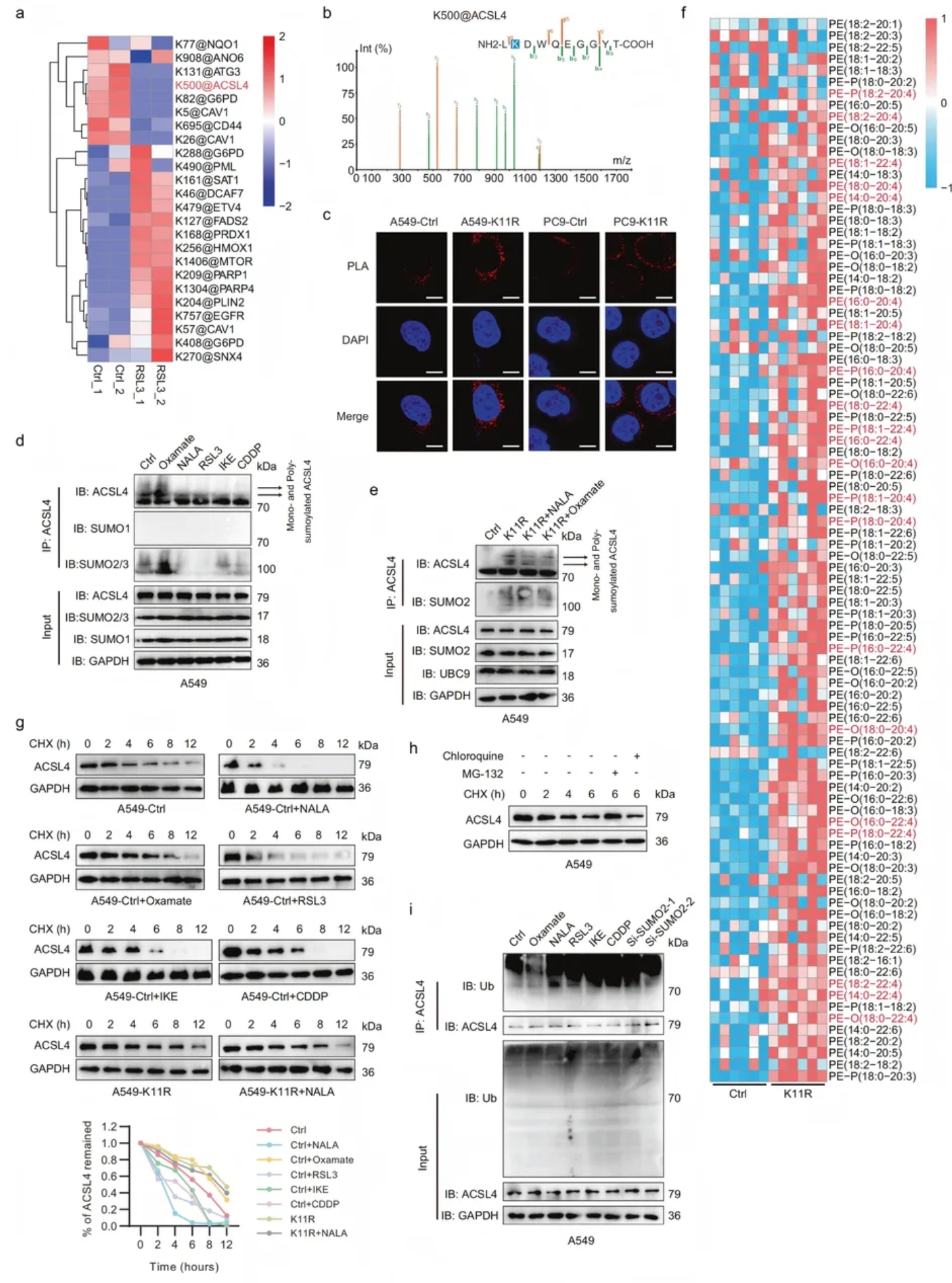
图4. SUMO2-K11la阻碍ACSL4在K500位点的SUMO化修饰,从而促进ACSL4的降解
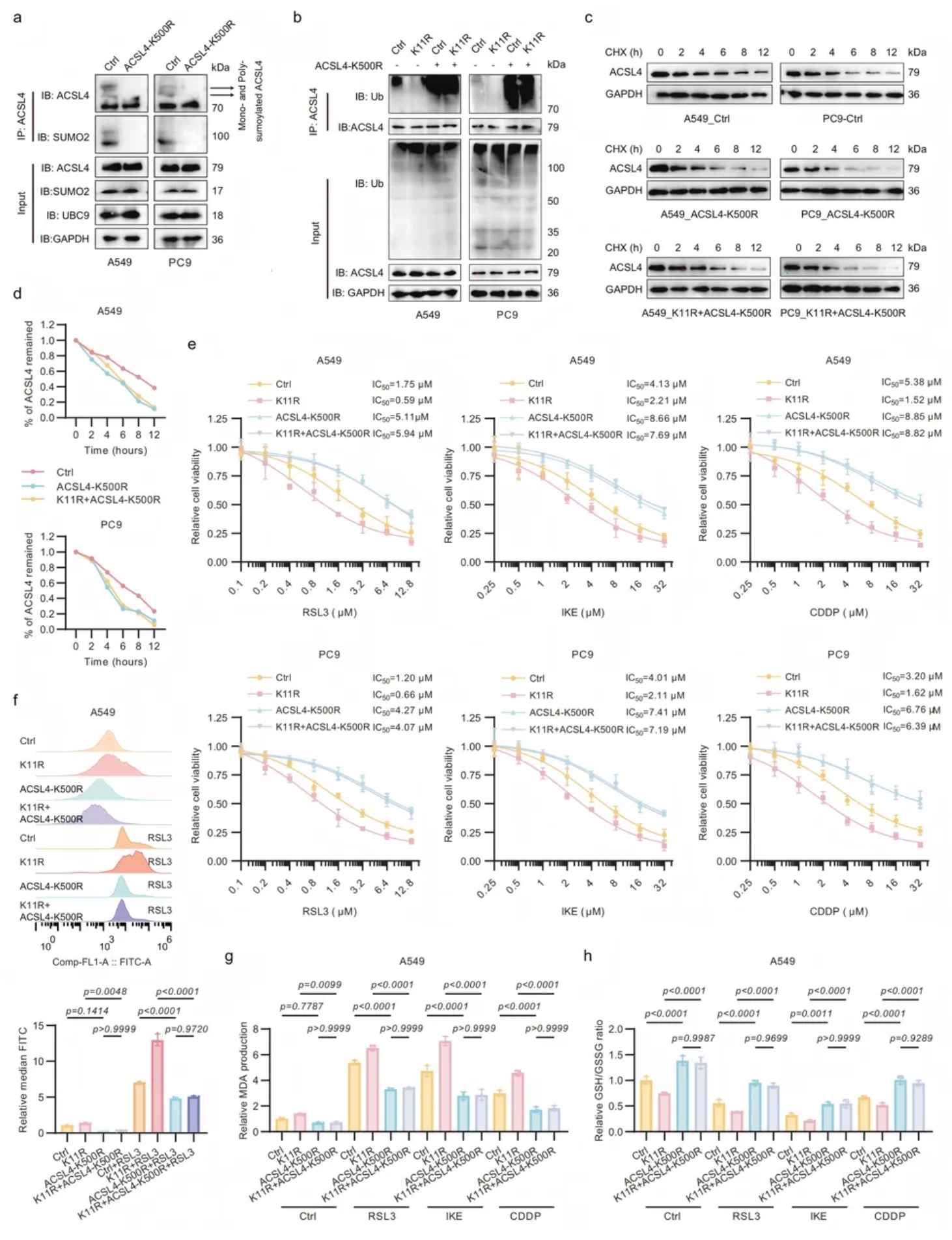
图5. ACSL4-K500R突变消除了SUMO2-K11la对铁死亡的影响
05.AARS1和HDAC1分别是SUMO2-K11la的乳酰转移酶和去乳酰基酶
为了描述酶对SUMO2-K11la的调控作用,本文对8种假定的乳酰转移酶和6种去乳酰基酶进行了sirna介导的沉默筛选(图6a),确定AARS1为SUMO2-K11la“写入酶”,HDAC1为“擦除酶”(图6b)。
AlphaFold3与突变实验证实AARS1-Lys823/SUMO2-Asp63互作(图6c-g),重组AARS1以ATP-LA依赖催化SUMO2-K11乳酸化(图6h-i);HDAC1抑制或敲除升高该修饰,激活则降低(图6j-k)。
铁死亡应激上调AARS1、下调HDAC1,促进SUMO2-AARS1结合并减弱SUMO2-HDAC1互作,形成正反馈:AARS1轻微保护细胞,HDAC1增强铁死亡敏感性(图6n-p)。
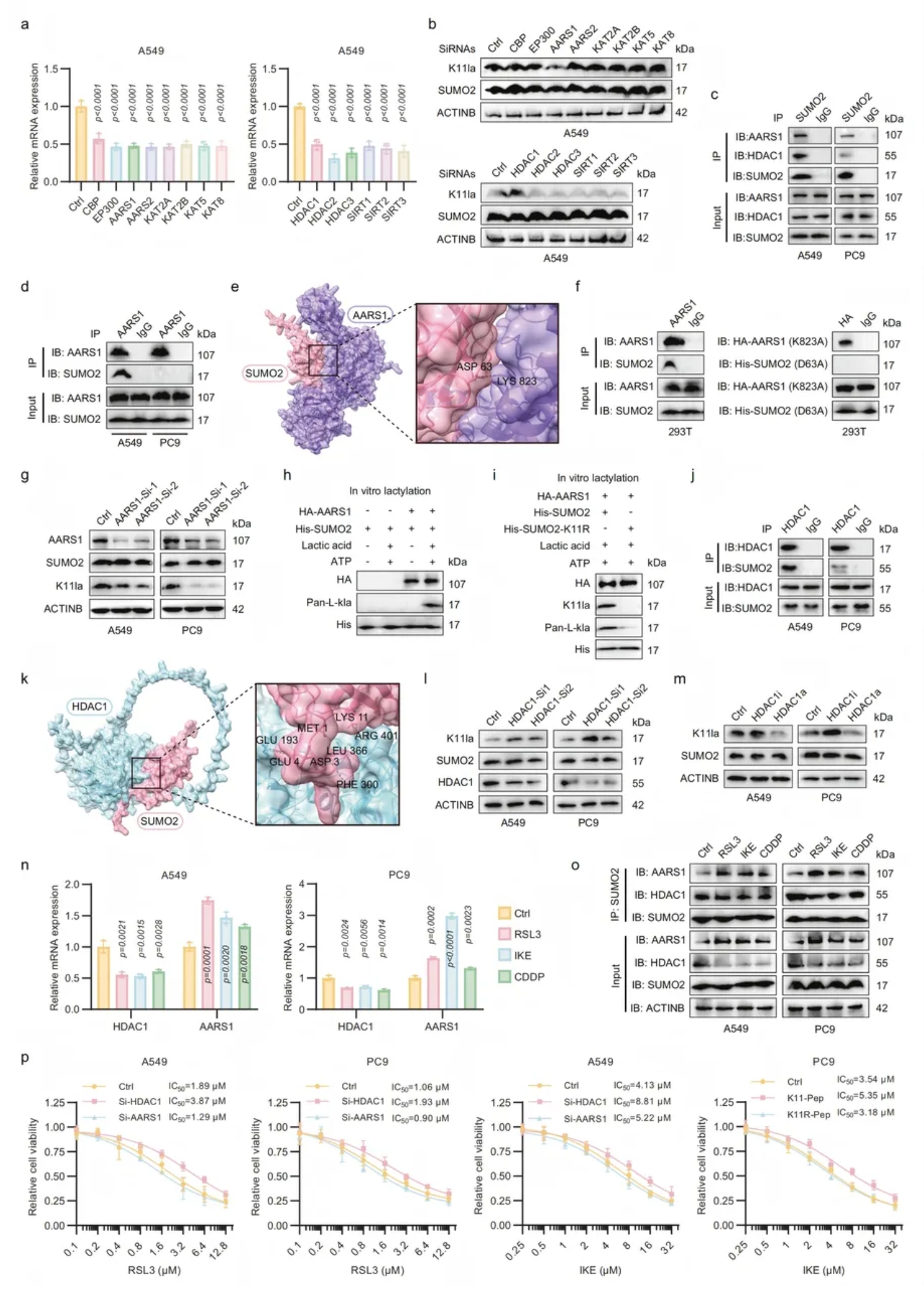
图6. AARS1 和 HDAC1 分别是 SUMO2-K11la 的乳酸转移酶和去乳酸化酶
06.通过肽抑制剂靶向SUMO2-K11la使LUAD对铁死亡和化疗联合免疫治疗增敏
为避免全身抑制AARS1或乳酸代谢的副作用,研究者设计并合成可穿透细胞的SUMO2-K11位点竞争性肽K11-Pep(阴性对照为K11R-Pep)(图7a)。
该肽无需转染即可进入核质(图7b),显著阻断SUMO2-K11la,恢复ACSL4的SUMO化并抑制其降解,从而增强脂质过氧化与铁死亡(图7c-e)。
在患者来源类器官中,K11-Pep明显协同IKE/CDDP抑制细胞活力;在裸鼠移植瘤模型中,K11-Pep联合IKE或CDDP显著减缓肿瘤生长,且未观察到主要脏器损伤及血象异常(图7f-j)。scRNA-seq显示SUMO2主要表达于肿瘤细胞,多重 IHC证实K11-Pep与T细胞共定位极少,提示其靶向安全性。
自发肺癌模型进一步表明,K11-Pep联合CDDP+anti-PD-1 可显著降低肿瘤负荷、延长生存,并提高瘤内CD8+/CD4+T 细胞比例及MDA/4-HNE水平,提示其通过促进铁死亡与免疫协同增强化免疗效(图7k-n)。
综上,K11-Pep选择性阻断SUMO2-K11la,具备安全、高效地增敏化疗及化免治疗的临床转化潜力。
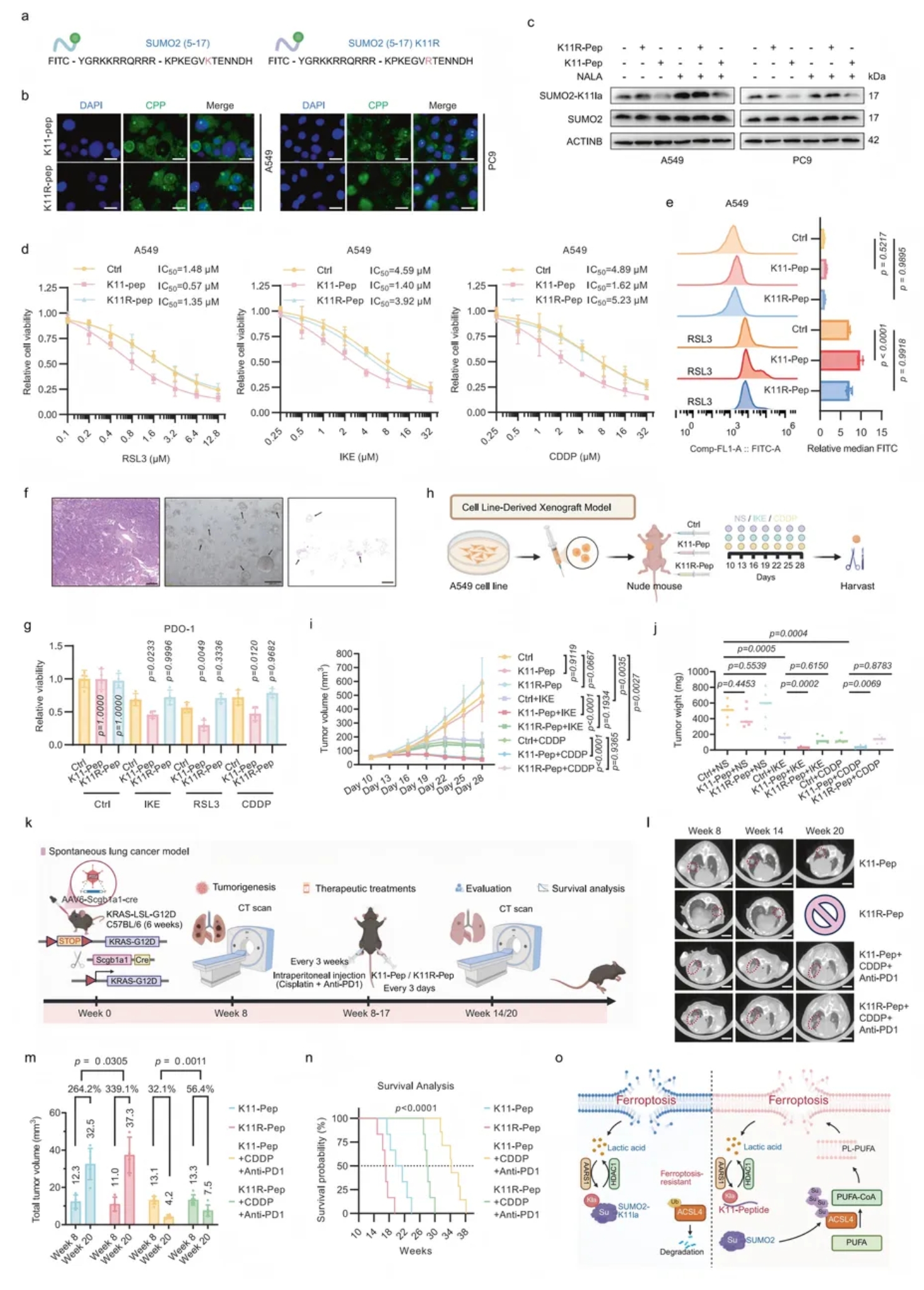
图7. 通过肽抑制剂靶向SUMO2-K11la使LUAD对铁死亡和化疗联合免疫治疗增敏
研究小结
本研究揭示SUMO2-K11la通过阻断ACSL4-SUMO化、加速其泛素降解,抑制铁死亡并降低化疗敏感性(图7o)。
铁死亡触发糖酵解-LA激增,选择性增强SUMO2-K11乳酸化;该模式在NSCLC和肝癌中保守,为全新代谢-表观交叉调控轴。AARS1和HDAC1分别担任“写入-擦除”酶,铁死亡应激上调AARS1、下调HDAC1,正反馈强化SUMO2-K11la。
靶向该修饰而非整体乳酸可避免副作用:开发的穿膜肽K11-Pep能特异阻断SUMO2-K11la,恢复ACSL4稳定性,在PDO、移植瘤及KrasG12D自发肺癌模型中均显著增敏铁死亡、CDDP和anti-PD-1疗法,安全有效,为LUAD提供新策略。
百趣生物定量脂质组学:是一款专注于脂质精准定量的靶标代谢组学产品,旨在为医学、农林、中医药、食品等领域的科研及产业需求提供高覆盖、高精准的脂质分析解决方案。作为公司主打产品,其通过自建超大脂质数据库、同位素内标一对一校正、双色谱柱(C18+HILIC)采集体系及三维严格质控,实现 “多、准、稳” 的检测优势,助力生物标志物发现、病理机制研究、作物品质改良等多场景应用。









