

文章标题:The anti-NMDAR1 antibodies and IL-17 signaling pathway shape NMDAR encephalitis
发表期刊:Molecular Psychiatry
影响因子:10.1
客户单位:南华大学附属第一医院
百趣提供服务:AQ700(现已升级为AQ1100高通量靶标定量)
研究背景
抗N-甲基-D-天冬氨酸受体(NMDAR)脑炎(NMDARE)是一种严重的自身免疫性疾病,其核心特征是患者脑脊液(CSF)和血清中存在靶向NMDAR1的自身抗体。该病临床表现复杂多样,常见癫痫发作、认知衰退及行为异常等,患者恢复周期长且易出现远期后遗症与复发。
尽管抗NMDAR1抗体被证实可通过诱导细胞表面NMDAR1内化减少,导致NMDAR功能低下,进而参与疾病发生,但癫痫发作等部分临床症状无法仅通过这一机制解释。研究已发现,NMDARE患者CSF中与血脑屏障损伤及脑炎症相关的细胞因子、趋化因子水平显著升高,提示脑炎症等其他因素可能共同介导疾病表型。
当前对NMDARE分子机制的理解主要依赖体外二维细胞培养和动物模型,前者难以复刻人脑复杂的细胞间相互作用,后者则缺乏人类免疫反应特异性,均存在明显局限。近年来发展的人类前脑类器官(human forebrain organoids, hFOs)作为多能干细胞衍生的三维培养模型,能够模拟人类大脑的复杂细胞结构与生理功能,已成功应用于病毒性脑炎等疾病研究,为精准解析NMDARE发病机制、开发新型治疗策略提供了新的平台。
研究结论
01.NMDAR1-Ab暴露降低hFOs中细胞表面NMDAR1的强度
研究者使用hFOs研究了靶向NMDAR1亚基的自身抗体(anti-NMDAR1 antibodies, NMDAR1-Ab)暴露的功能效应。hFOs由一名健康供体来源的人诱导多能干细胞(hiPSCs),根据已发表的方法诱导生成(图1a)。生成的hFOs具有前脑特征,包含类似脑室的结构、中间区和皮质样区域(图1b)。除了神经谱系细胞类型外,表达星形胶质细胞标记或寡突胶质细胞标记的细胞也存在于hFOs中(图1c),表明hFOs包含了发育中人脑中存在的主要细胞类型。重要的是,免疫染色证实了NMDAR1在hFOs中的广泛表达(图1c)。
先前的一项研究使用靶向NMDAR1 N端结构域的商业抗体和人NMDAR1-Ab来构建NMDARE模型。在此,根据先前研究中使用的抗NMDAR1 IgG浓度,将第110天的hFOs暴露于靶向NMDAR1 N端结构域的商业单克隆抗体或对照IgG 24小时。免疫染色分析显示,NMDAR1-Ab暴露不影响神经元的总密度,但导致hFOs中细胞表面NMDAR1几乎完全消失(图1d-e)。为了在NMDARE患者中验证这些发现,收集了6名诊断为NMDARE的患者和6名对照的CSF样本。基于细胞的检测证实了所有患者CSF样本中均存在抗NMDAR1 IgG抗体。然后从NMDARE患者或对照的混合CSF样本中纯化了IgG抗体。暴露于患者CSF来源的IgG抗体的hFOs也显示细胞表面NMDAR1几乎完全消失,但未改变hFOs中神经元的总密度(图1f-g)。

图1.NMDAR1-Ab暴露降低了hFOs中细胞表面NMDAR1的强度
02.NMDAR1-Ab暴露影响神经元突触传递及谷氨酸能通路相关基因表达
接下来进行了RNA-seq分析,NMDAR1-Ab暴露组和对照组hFOs之间的差异基因表达分析共鉴定出2958个差异表达基因(DEGs)。在这2958个DEGs中,1646个基因在NMDAR1-Ab暴露的hFOs中上调,1312个基因下调(图2a)。
使用WebGestalt对DEGs进行功能注释,发现1646个上调的DEGs,在前体代谢物和能量产生、核糖核蛋白复合物生物发生和RNA剪接等生物学功能中富集。KEGG通路分析显示,1646个上调的DEGs与亨廷顿病、阿尔茨海默病、帕金森病和氧化磷酸化在内的通路相关(图2b)。
对于1312个下调的DEGs,GO富集分析显示它们在轴突发育、跨突触信号调节、突触小泡循环和钙离子调节的胞吐作用中显著富集。KEGG通路分析显示,这1312个下调的DEGs与尼古丁成瘾、吗啡成瘾、轴突导向、GABA能突触和谷氨酸能突触等通路相关(图2c)。这些结果强调了NMDAR1-Ab暴露下调了富集于多种神经元功能(包括谷氨酸能突触)的基因集。
对下调的DEGs,基于STRING数据库构建了PPI网络。然后使用CytoHubba来探索PPI网络中的关键调节因子。CytoHubba中可用的12种算法中有9种将GRIN1和GRIA2识别为PPI网络中的前两个枢纽节点(图2d)。需要注意的是,GRIN1和GRIA2分别编码NMDAR的NR1亚基和AMPA选择性谷氨酸受体2。据报道,这两个基因的突变与神经发育障碍相关。通过RT-qPCR分析,研究者证实了与对照组相比,NMDAR1-Ab暴露的hFOs中GRIN1和GRIA2的表达降低(图2e)。
为确认RNA-seq结果的可靠性,研究者用从NMDARE患者或对照CSF中纯化的IgG抗体处理hFOs 24小时,RT-qPCR检测显示,患者CSF来源的IgG同样会导致GRIN1和GRIA2表达降低(图2f)。
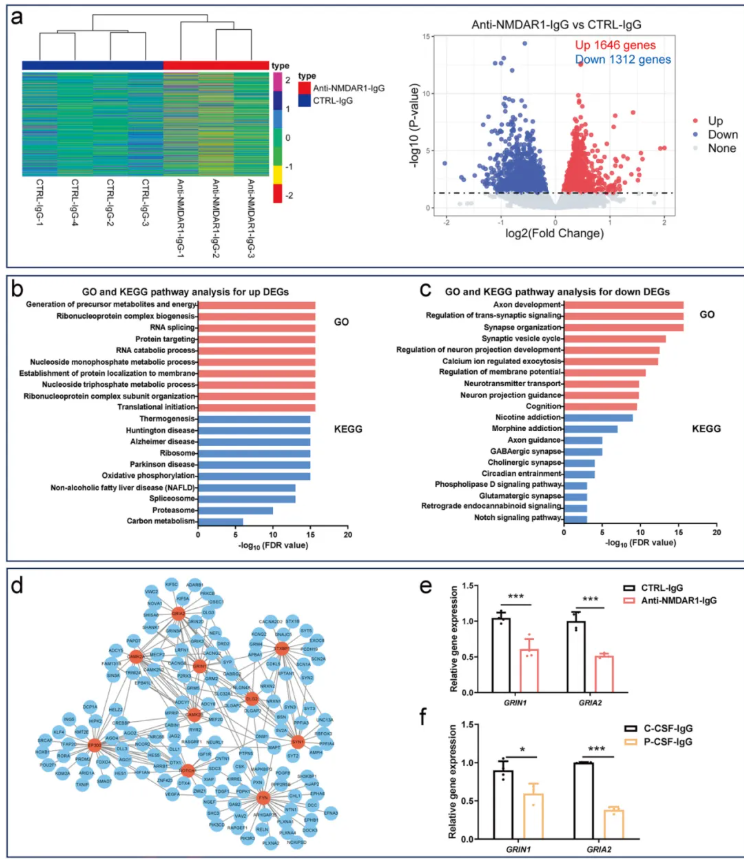
图2.hFOs经NMDAR1-Ab暴露后的RNA-seq分析结果
03.受NMDAR1-Ab暴露影响的基因富集于神经精神疾病相关通路
为探索NMDAR1-Ab暴露与人类疾病的关联,研究者利用1312个下调的DEGs,通过DisGeNET数据库进行基因-疾病关联分析。结果显示,这1312个下调DEGs显著富集于多种脑部疾病,包括精神分裂症、失神癫痫、自闭症谱系障碍、智力残疾和双相情感障碍。值得注意的是,PPI网络中的核心枢纽基因GRIN1和GRIA2,均已被报道与多种神经精神疾病相关。
为进一步验证这一关联,研究者通过FUMA-GWAS工具进行分析,结果显示该组下调DEGs同样富集于与脑部疾病遗传相关的基因集,具体包括精神分裂症、认知能力、癫痫和神经质一般因子。上述结果共同表明,NMDAR1-Ab暴露可通过调控神经精神疾病相关基因的表达,参与NMDARE患者中神经精神症状的发生。
04.代谢组分析证实NMDAR1-Ab暴露后hFOs中谷氨酸水平降低
RNA-seq分析揭示了NMDAR1-Ab暴露对谷氨酸能突触的影响,后进行代谢组分析以检测NMDAR1-Ab暴露是否降低了hFOs中的谷氨酸水平。检测到的206种代谢物中,共有12种代谢物在NMDAR1-Ab暴露组和对照组hFOs之间存在差异表达。在这12种差异代谢物中,4种代谢物在NMDAR1-Ab暴露的hFOs中上调,L-谷氨酸在内的8种代谢物下调(图3a)。
KEGG通路分析显示,这12种差异代谢物与抗坏血酸和醛糖酸代谢、精氨酸生物合成和谷胱甘肽代谢等通路相关(图3b)。患者CSF来源IgG抗体的hFOs,也导致L-谷氨酸含量降低(图3c)。RNA-seq和RT-qPCR分析显示,NMDAR1-Ab暴露后hFOs中GLUD1和GLUL基因表达显著上调——这两个基因分别编码可将谷氨酸转化为α-酮戊二酸和谷氨酰胺的酶;而编码谷氨酰胺酶(催化谷氨酸生成的关键酶)的GLS基因,其表达在NMDAR1-Ab暴露后未发生改变,提示谷氨酸的生成过程未受影响(图3d)。
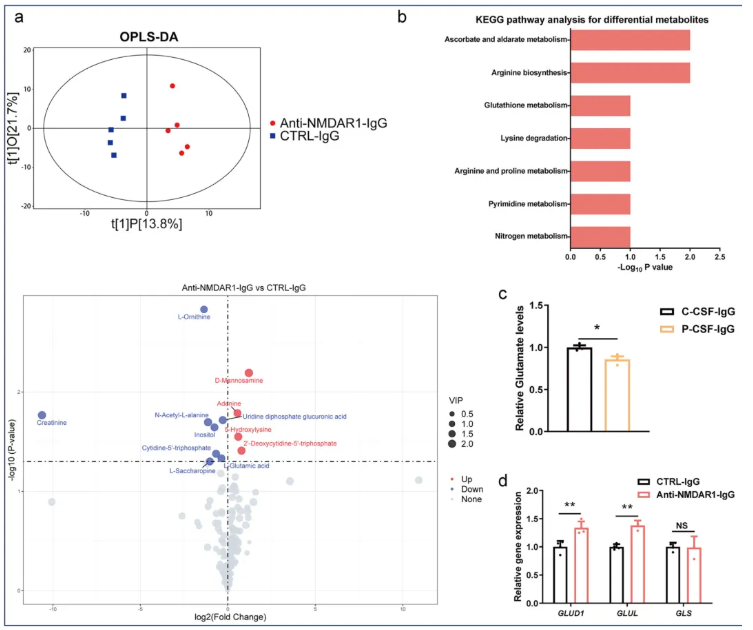
图3.NMDAR1-Ab暴露后的代谢组分析
05.NMDAR1-Ab暴露导致hFOs中神经元活动减弱
RNA-seq和代谢组学分析均提示,NMDAR1-Ab暴露会抑制hFOs的谷氨酸能功能。为明确该效应是否影响神经元电生理活动,研究者采用微电极阵列(MEA)技术进行检测。将培养至第110天的hFOs与10 μg/mL 单克隆NMDAR1-Ab或对照IgG共同孵育24小时后,MEA系统记录显示:与对照组相比,NMDAR1-Ab暴露组hFOs的峰电位数量显著减少,加权平均发放率明显降低,表明神经元活动减弱(图4a)。这一结果通过钙成像分析得到证实(图4b)。为确认该现象的临床相关性,研究者用从NMDARE患者脑脊液中纯化的IgG抗体处理hFOs,MEA检测显示患者CSF来源的IgG同样会导致hFOs神经元活动减弱(图4c)。上述结果表明,仅NMDAR1-Ab本身可导致hFOs神经元活动减弱,而非NMDARE患者体内观察到的神经元过度兴奋,提示患者体内的神经元过度兴奋可能由其他因素介导。
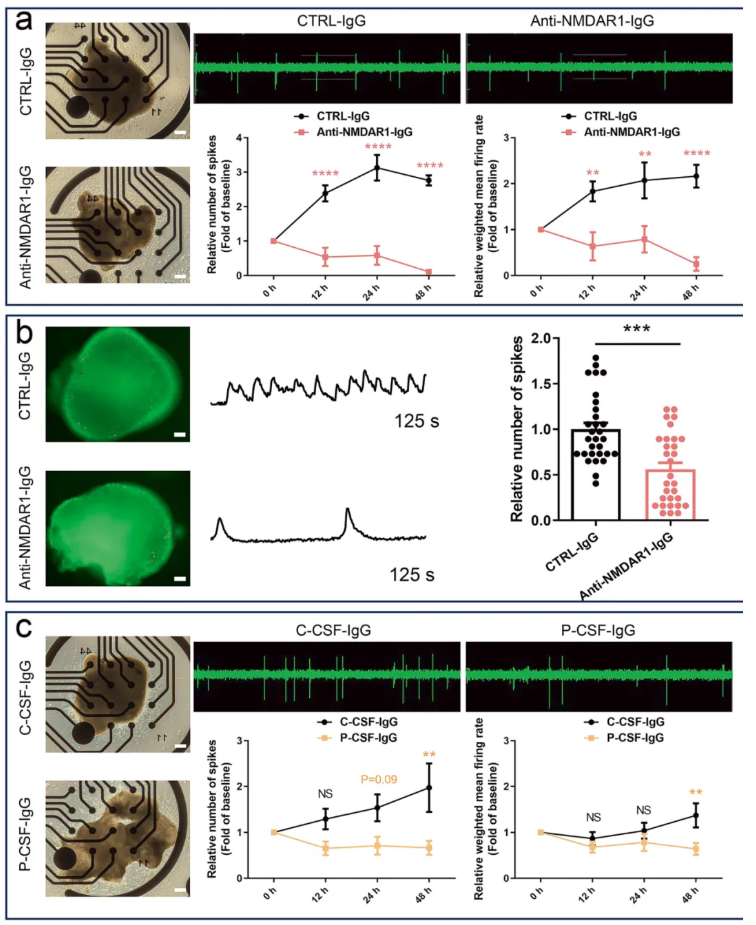
图4.NMDAR1-Ab暴露导致hFOs神经元活动减弱
06.患者CSF及去IgG患者CSF均诱导hFOs神经元过度兴奋
研究者进一步测试了患者CSF对神经元活动的影响。免疫染色分析显示,患者CSF显著降低了hFOs细胞表面NMDAR1的密度(图5a),但未改变神经元总密度。MEA和钙成像分析结果显示,与对照组相比,暴露于混合患者CSF的hFOs表现出神经元过度兴奋(图5b)。
鉴于此前已证实患者CSF来源的纯化IgG抗体(核心成分为NMDAR1-Ab)会导致神经元活动减弱,上述结果提示,患者CSF中诱导神经元过度兴奋的物质并非IgG抗体。为证实这一点,从患者CSF中去除IgG抗体,并用其上清处理hFOs,MEA分析显示,该组hFOs仍表现出神经元过度兴奋(图5c)。
综上,这些结果证实,患者CSF中导致神经元过度兴奋的关键物质并非NMDAR1-Ab,而是其他成分。
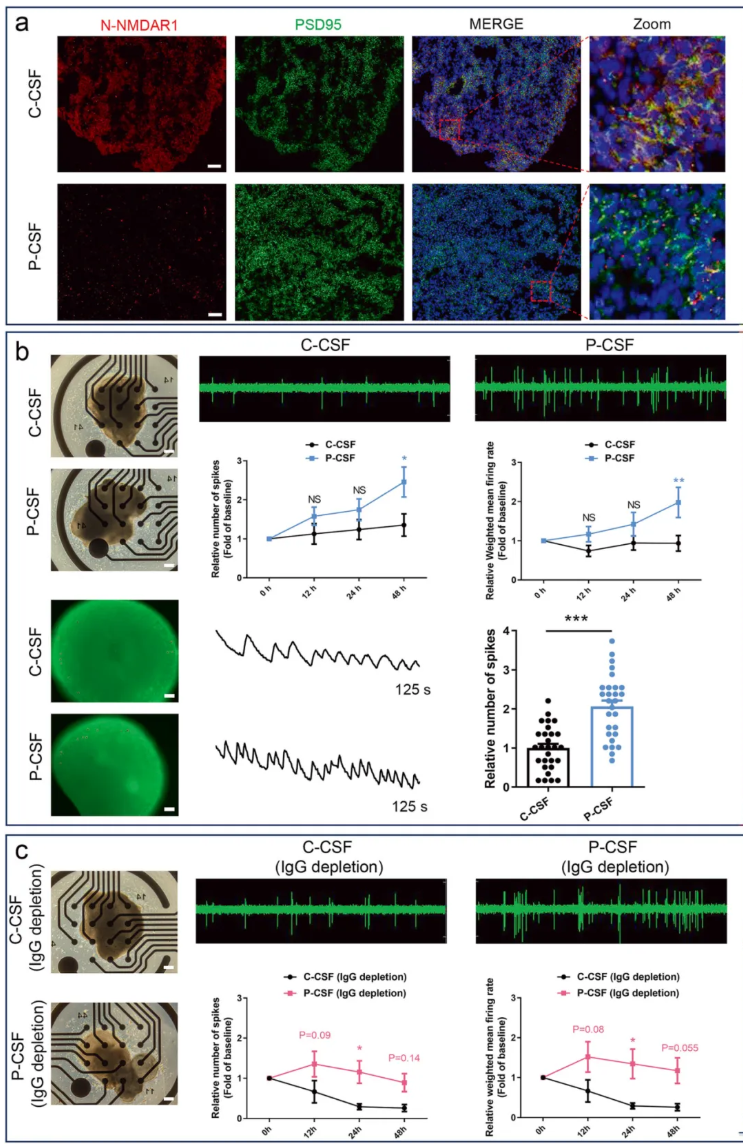
图5.NMDARE患者CSF及去除IgG的CSF引起hFOs神经元活动过度
07.患者CSF中激活的IL-17信号通路介导神经元过度兴奋
NMDARE患者常存在脑部炎症升高的情况,且炎症可调节神经元活动,因此推测患者CSF中促炎因子可能导致神经元过度兴奋。使用来自6名NMDARE患者和6名对照的CSF样本进行了Olink蛋白质组学分析。鉴定出14种差异蛋白,包括促炎因子IL-6和干扰素-γ(图6a)。值得注意的是,所有14种差异蛋白在NMDARE患者CSF中均上调。这14种上调的蛋白质在对外部刺激的正调控、T细胞激活和IL-17信号通路中富集(图6b)。
由于IL-17在驱动炎症中起关键作用,IL-17信号通路的激活可能表明NMDARE患者CSF中存在炎症。最近的一项分析显示,NMDARE患者CSF中包括IL-17、IL-6和IFN-γ在内的促炎因子含量显著高于对照组。鉴于IL-17可以诱导IL-6和IFN-γ的释放,IL-17信号通路的激活可能是导致神经元过度兴奋的根源。为了验证这一假设,用100 ng/mL的IL-17处理hFOs。RT-qPCR分析证实,IL-17暴露后,hFOs中IL-17信号通路的两个关键激活因子(ACT1和TRAF6)上调(图6c),表明IL-17信号通路被激活。随后的MEA和钙成像分析显示,与对照组相比,暴露于IL-17的hFOs表现出神经元过度兴奋(图6d-e)。为了进一步确认IL-17在神经元活动中的作用,将hFOs暴露于去除IgG的患者CSF(含或不含抗IL-17单克隆抗体)和去除IgG的对照CSF。后续MEA检测显示,中和IL-17可缓解去IgG患者CSF诱导的hFOs神经元过度兴奋(图6f)。这些结果表明,患者CSF中激活的IL-17信号通路是导致神经元过度兴奋的原因。
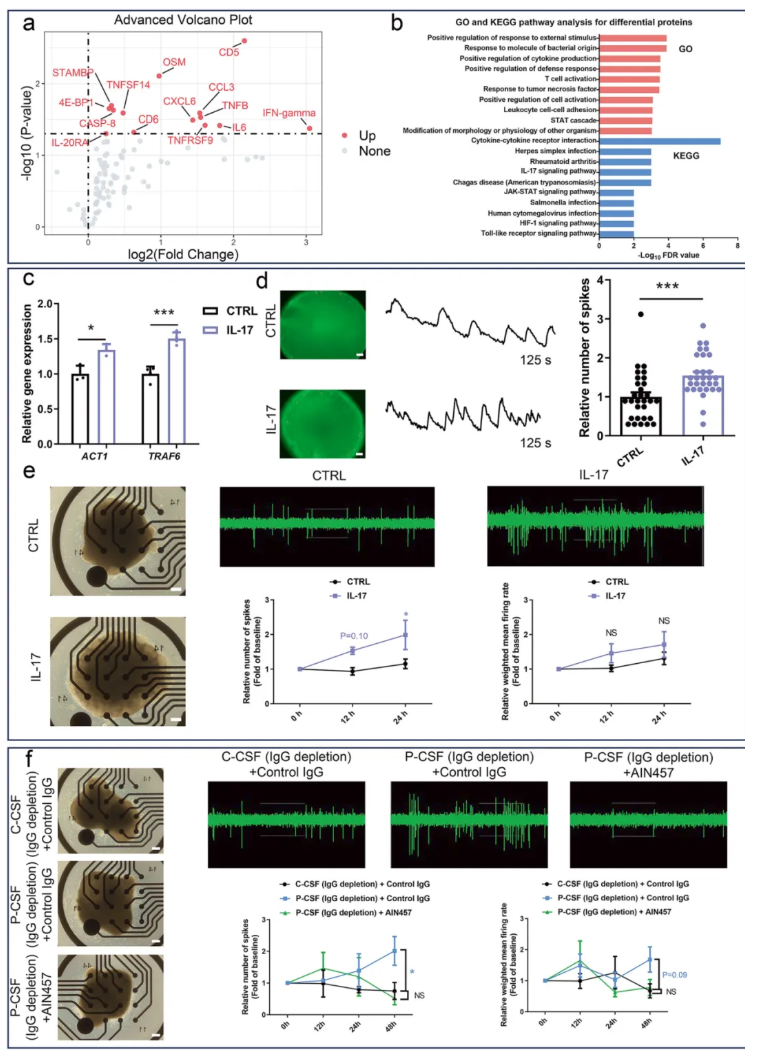
图6.患者CSF中激活的IL-17信号通路是神经元过度兴奋的原因
08.中和IL-17可减轻NMDARE患者CSF诱导的小鼠癫痫样行为
为在体内进一步验证IL-17信号通路对神经元活动的影响,通过微型渗透泵构建了脑室内输注NMDARE患者或非患病对照CSF的小鼠模型(图7a)。在输注后的前7天,注射对照CSF或患者CSF的小鼠均未出现癫痫样行为。
为诱导癫痫样表型,在第7天给小鼠腹腔注射阈下剂量的戊四氮(PTZ,一种癫痫诱导剂)。结果显示,在此剂量下,注射对照CSF+PTZ的小鼠未出现癫痫样行为,而所有注射患者CSF+PTZ的小鼠,在PTZ注射后5分钟内均表现出癫痫样行为。这表明,暴露于NMDARE患者CSF的小鼠比对照组更易诱发癫痫。
有趣的是,预先用抗IL-17单克隆抗体处理的小鼠,其癫痫样表型的严重程度显著降低(图7b)。这些结果进一步证实,激活的IL-17信号通路是导致神经元过度兴奋的关键原因。
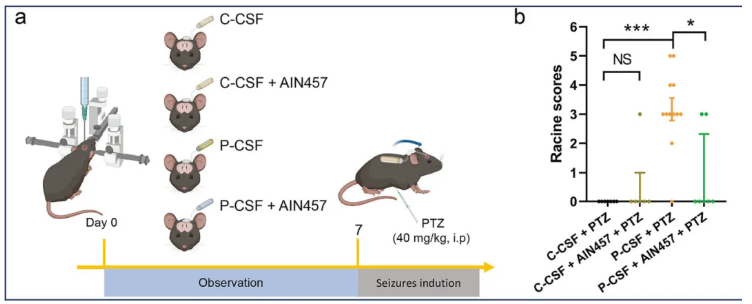
图7.中和IL-17可减轻NMDARE患者CSF诱导的小鼠癫痫样行为
研究总结
本研究通过人脑类器官多组学分析,系统揭示了NMDARE的双重发病机制:
1.抗NMDAR1抗体通过内化NMDA受体、下调谷氨酸能突触功能,导致神经元活动减弱,可能与精神症状相关
2.IL-17信号通路的激活是引起神经元过度兴奋和癫痫样行为的关键因素
因此,靶向 IL-17 信号通路的干预手段,有望成为 NMDARE 的潜在治疗方向,在癫痫症状的针对性调控中更具应用潜力。后续仍需通过更多临床研究,进一步验证 IL-17 作为该疾病生物标志物与治疗靶点的临床价值。
AQ1100高通量靶标定量:AQ1100是一种高通量靶标代谢组学检测分析方法,可检测20大类共计1100余种代谢物,涵盖生物体内关键代谢通路的核心代谢物、肠道菌群相关代谢物,以及文献中已报道的各类生物标志物。这些代谢物在生理稳态维持、病理机制调控等诸多健康与疾病相关生理过程中发挥关键作用。AQ1100采用高灵敏度三重四极杆质谱仪,可在较短时间内对样本中1100余种代谢物实现精准、快速的定性与定量分析,实现对样本代谢谱的全面解析。









