

文章标题:An antioxidant, injectable hydrogel with mitochondrial fusion effect promotes inflamed dental pulp repair via immunomodulation and reactive oxygen species scavenging
发表期刊:Biomaterials
影响因子:12.9
客户单位:北京大学口腔医院
百趣提供服务:靶标代谢流
研究背景
牙髓炎是常见牙科疾病,传统根管治疗需彻底去除活髓组织,导致牙齿进入非生理状态,不仅不利于年轻恒牙发育和成熟,还可能影响恒牙的长期留存。活髓治疗(Vital pulp therapy,VPT)因能保留牙髓组织成为更理想的方案。VPT的成功关键在于盖髓材料需同时控制炎症级联反应、调节牙髓炎症微环境,且缓解氧化应激。但现有临床盖髓材料易引发残余牙髓慢性炎症、异位钙化,且缺乏同步调控免疫和清除ROS的双功能。在炎症微环境中,巨噬细胞难以从促炎M1型极化至修复M2型,是牙髓修复的核心障碍。研究兼具免疫调节和抗氧化双功能、能适配牙髓损伤形态的新型盖髓材料,利用多组学技术探讨新型盖髓材料发挥双重效应的潜在机制,提供了一种解决新型的牙髓炎活髓治疗技术。
研究结论
01.MASM7在炎症条件下促进THP-1-M细胞线粒体融合并调控M2极化
为验证促进线粒体融合的“线粒体胶水”在脂多糖(Lipopolysaccharide,LPS)诱导的炎症微环境中,是否能促进THP-1来源巨噬细胞(THP-1-derived macrophages,THP-1-M)的线粒体融合,并调控其从促炎M1型向修复M2型极化,明确MASM7的免疫调节作用及机制,研究通过超分辨光学显微镜和透射电子显微镜观察线粒体形态,采用免疫荧光染色检测巨噬细胞特异性标志物及极化标志物的表达;通过qPCR和ELISA检测极化相关细胞因子的水平;同时用MFN2 si-RNA下调MFN2表达,验证MASM7作用的特异性。
结果显示,LPS处理后THP-1-M的线粒体呈碎片化、肿胀,线粒体分裂相关标志物上调,而融合标志物下调,巨噬细胞向M1型极化;而MASM7处理后,线粒体恢复伸长形态,融合能力显著增强(图1a-c),免疫荧光染色显示LPS+MASM7组CD68+/CD86+(M1型)细胞减少、CD68+/CD206+(M2型)细胞增多(图 1d-e),qPCR和ELISA结果表明该组促炎因子TNF-α、IL-6、iNOS 表达显著降低,抗炎症标志物Arg-1表达升高(图1f);下调MFN2后,MASM7无法诱导线粒体融合,也不能促进M2极化,CD68+/CD206+细胞数量较LPS+MASM7组减少。综合表明,MASM7可通过促进线粒体融合,在炎症微环境中有效调控THP-1-M从M1型向M2型极化,其作用依赖 MFN2介导的线粒体融合通路。
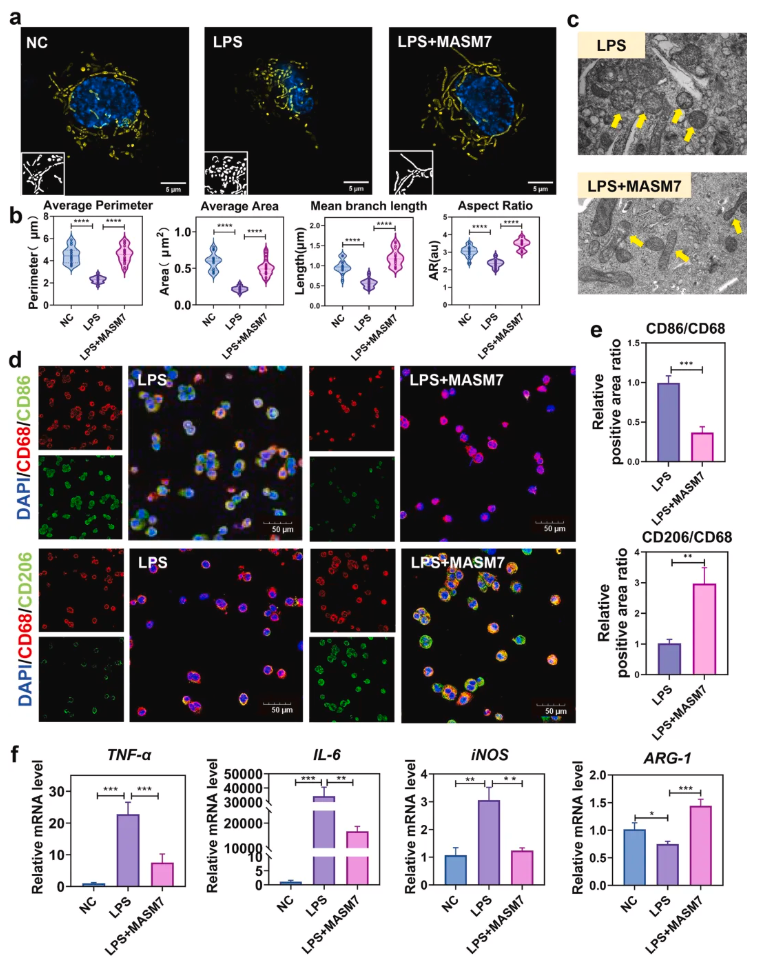
图1.MASM7在炎症条件下促进THP-1-M细胞的线粒体融合,并诱导M2极化
02.MASM7在炎症微环境中导致THP-1-M细胞的主要代谢过程从糖酵解向氧化磷酸化转移
为探究MASM7通过THP-1-M细胞极化的潜在代谢机制,明确炎症条件下MASM7是否能诱导THP-1-M细胞代谢模式从糖酵解向氧化磷酸化(Oxidative phosphorylation,OXPHOS)转变。采用靶标代谢组学和靶标代谢流技术分别分析糖酵解及三羧酸循环途径的差异代谢物和代谢流变化,明确代谢途径的真实活性。结果显示,LPS组THP-1-M细胞的基础呼吸、最大呼吸及ATP生成相关呼吸水平显著降低,基础糖酵解水平显著升高(图2a-c);靶标代谢组学鉴定出17种差异代谢物参与糖酵解和TCA循环通路,其中6种显著上调,8种显著下调(图2d)。代谢通量分析(metabolic-flux analysis,MFA)结果显示,LPS+MASM7组糖酵解相关标记代谢物(GAP、DHAP)水平受抑,而TCA循环相关标记代谢物(苹果酸、柠檬酸)水平上调(图2e-f),这表明MASM7在炎症微环境中增强了OXPHOS并抑制了糖酵解。关键代谢物变化通路图明确了MASM7诱导代谢重编程的关键节点,证实其可抑制糖酵解、增强OXPHOS(图2g)。综上所述,在炎症微环境中,MASM7可导致THP-1-M细胞发生代谢重编程,使主要代谢过程从糖酵解转向OXPHOS。
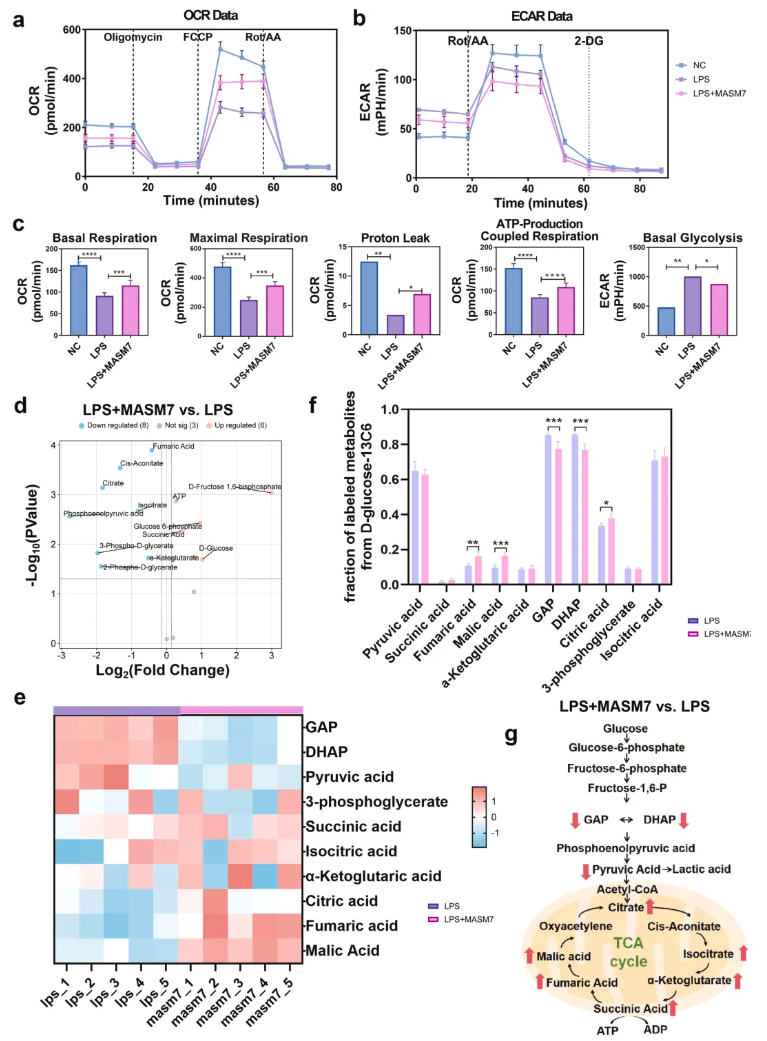
图2.MASM7诱导经LPS处理的THP-1-M细胞代谢重编程,从糖酵解转向OXPHOS
03.MASM7处理的THP-1-M细胞在炎症微环境中增强DPSCs的修复能力
为验证经MASM7处理的THP-1-M细胞,在炎症微环境中是否能增强牙髓干细胞(Dental pulp stem cells,DPSCs)的修复能力,明确巨噬细胞极化对DPSCs成牙分化的调控作用。按照图3a所示将DPSCs与THP-1-M共培养,结果显示,与LPS刺激使DPSCs中促炎细胞因子表达上调,而MASM7处理抑制促炎因子水平(图3b)。ALP和ARS染色显示ALP表达受到LPS抑制,但经MASM7处理后该现象被逆转(图3c)。WB显示DSPP和DMP-1在LPS+MASM7处理的THP-1-M细胞共培养的DPSCs中表达更高(图3e-f)。这些结果表明,在炎症微环境中,THP-1-M细胞会降低DPSCs的修复能力,而MASM7能在一定程度上逆转这种效应。采用RNA测序技术探究共培养细胞间的转录组变化,聚类分析显著差异基因的热图展示了不同组间的基因分布特征(图3g)。MA图呈现OM组与OM+LPS组或OM+LPS组与OM+LPS+LPS组间基因表达差异(图3h-i)。结果显示OM+LPS+MASM7组IL-6表达降低、ALP表达升高,KEGG分析提示差异基因富集于炎症通路和组织修复通路(图3j)。
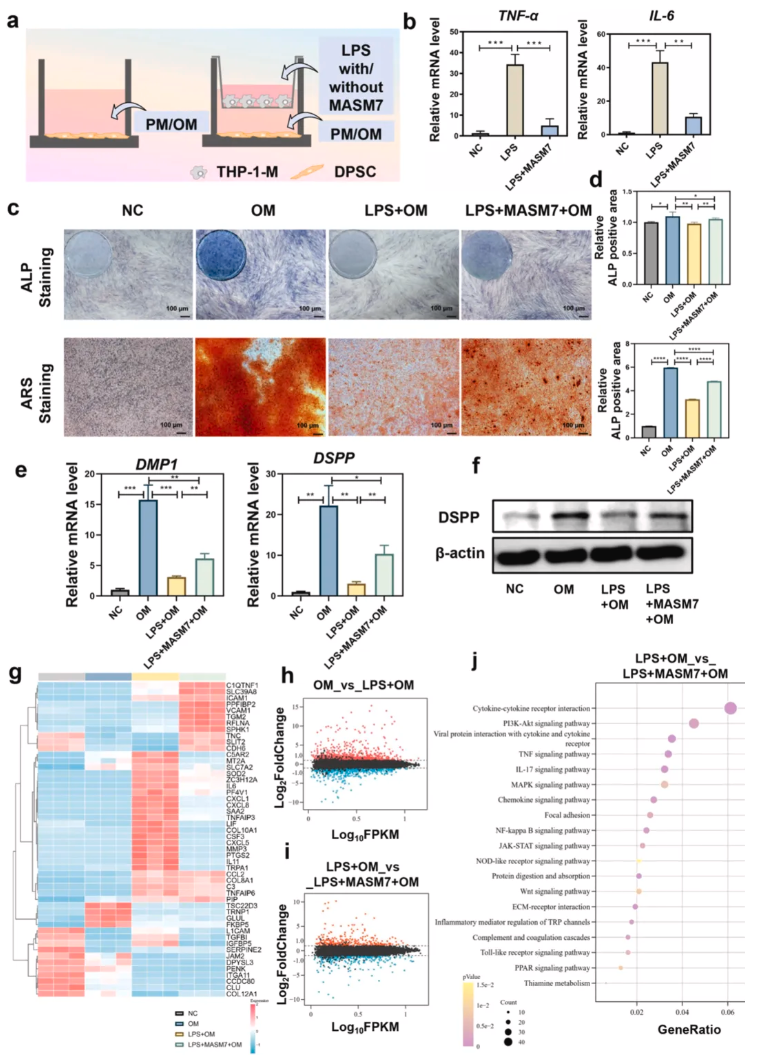
图3.在炎症微环境中,经MASM7处理的THP-1-M可增强DPSCs的修复能力
04.CSMAGA表现出良好的注射性、抗氧化能力及生物相容性
为验证CSMAGA水凝胶的核心理化性能与生物安全性,以壳聚糖为原料,经甲基丙烯酸酐改性合成甲基丙烯酸化壳聚糖,再通过EDC催化偶联没食子酸制备CSMAGA;采用¹H NMR、FT-IR、UV-vis表征化学结构。结果显示,¹H NMR和FT-IR证实甲基丙烯酸化壳聚糖的碳碳双键及CSMAGA的邻苯三酚基团成功接枝(图4a-b);CSMAGA前驱液可通过针管连续挤出,UV照射30s快速成胶,兼具可注射性与原位成胶能力(图4c);DPPH和ABTS实验表明CSMAGA可清除80%以上的自由基,EPR光谱证实其自由基清除效能,且能显著降低H₂O₂诱导的DPSCs内ROS水平,提高细胞存活率(图4d-h);活死染色和CCK-8结果显示,DPSCs与CSMAGA直接接触后活力大于90%,且支持细胞增殖;体内荧光成像显示Cy5.5标记的CSMAGA在小鼠皮下21天内完全降解(图4i-j)。
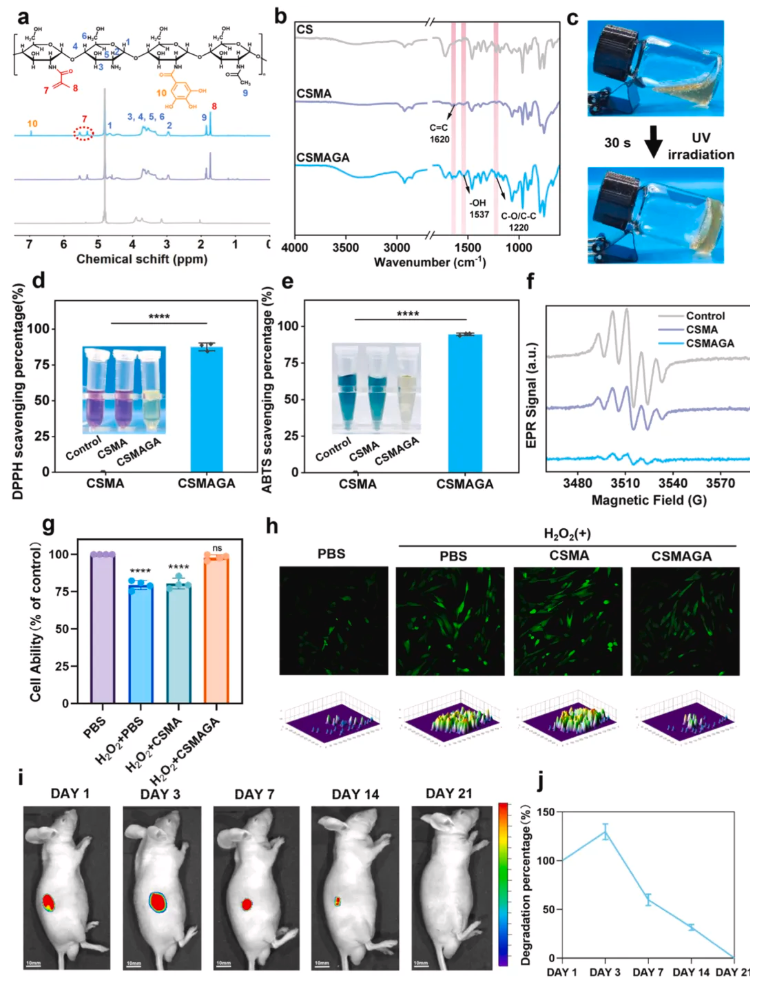
图4.甲基丙烯酸化壳聚糖与CSMAGA的合成及表征
05.MASM7@CSMAGA水凝胶通过免疫调节与抗氧化双重作用促进大鼠牙髓炎症修复
为验证MASM7@CSMAGA水凝胶在体内是否能通过免疫调节和抗氧化双效作用,促进LPS诱导的牙髓炎大鼠的炎症牙髓修复,明确其相较于传统盖髓材料MTA的优势。采用H&E染色评估验证细胞浸润和牙髓组织修复情况,免疫荧光染色检测牙髓组织中炎症因子(TNF-α、IL-6)及巨噬细胞极化标志物的表达;免疫组化染色检测成牙特异性标志物DSPP的表达及阳性面积。结果显示,术后3天,MASM7@CSMAGA组牙髓组织的炎症细胞浸润程度显著轻于LPS组和CSMAGA组(图5a),TNF-α、IL-6的荧光信号强度显著降低(图5b-c);免疫荧光结果表明MASM7@CSMAGA组的CD68+iNOS+(M1型)巨噬细胞数量减少,CD68+CD206+(M2型)巨噬细胞数量显著增加,免疫调节效果优于其他两组(图6a-c)。术后14天,H&E染色显示MASM7@CSMAGA组暴露牙髓周围形成连续牙本质桥,组织内无弥散钙化,CSMAGA组牙本质桥形成延迟且仍有轻微炎症细胞浸润(图7a);免疫组化结果显示,CSMAGA组和MASM7@CSMAGA组的DSPP阳性面积均大于LPS组,其中MASM7@CSMAGA组的DSPP表达更集中于修复区域,提示成牙分化更活跃(图7b-c)。
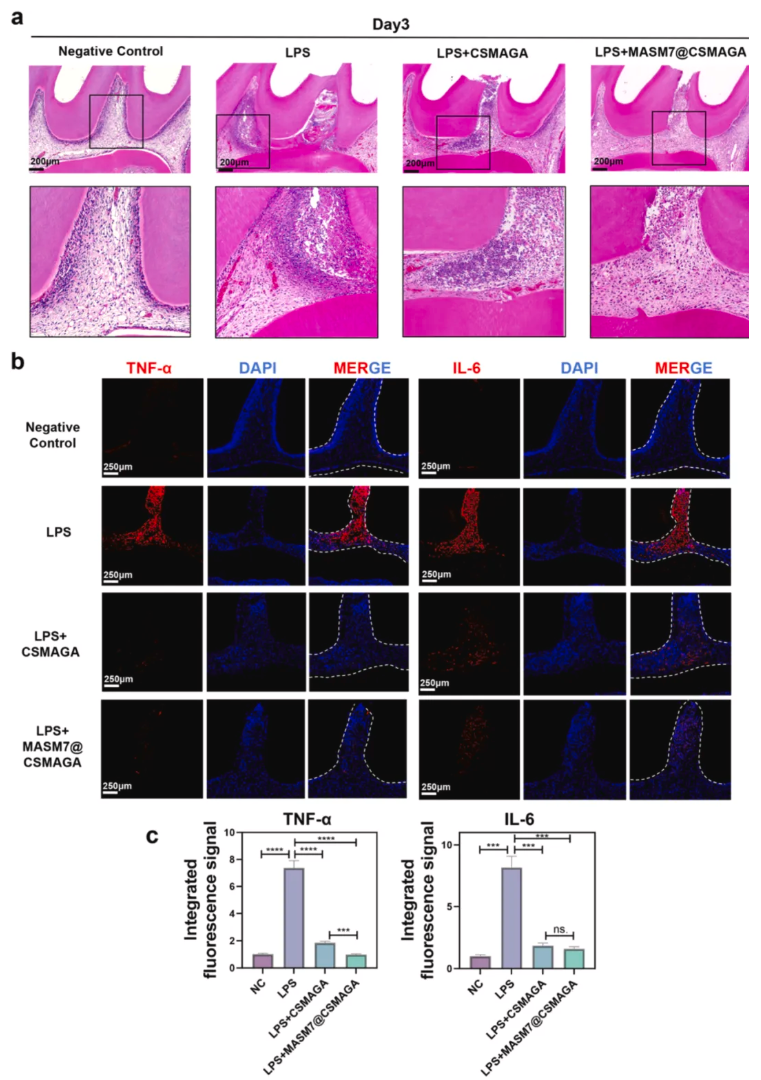
图5.大鼠牙髓炎模型第3天炎症水平
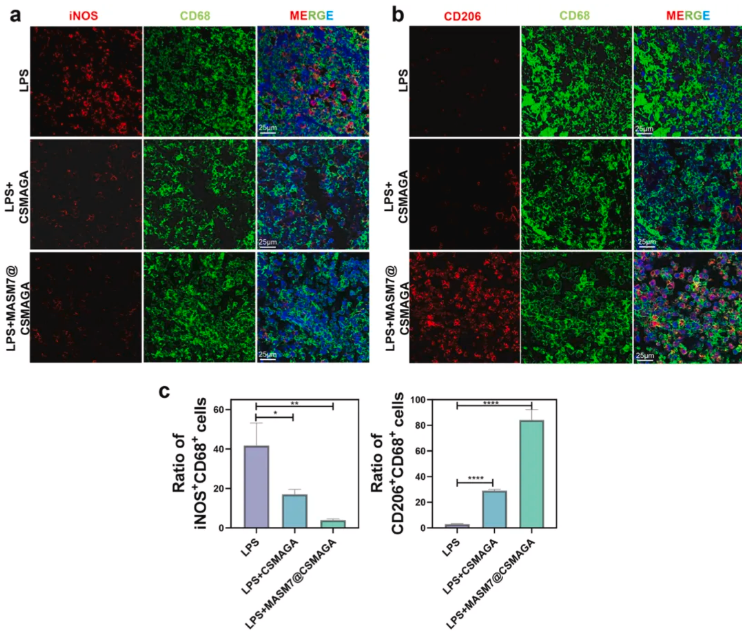
图6.MASM7@CSMAGA水凝胶在牙髓炎模型中诱导免疫调节
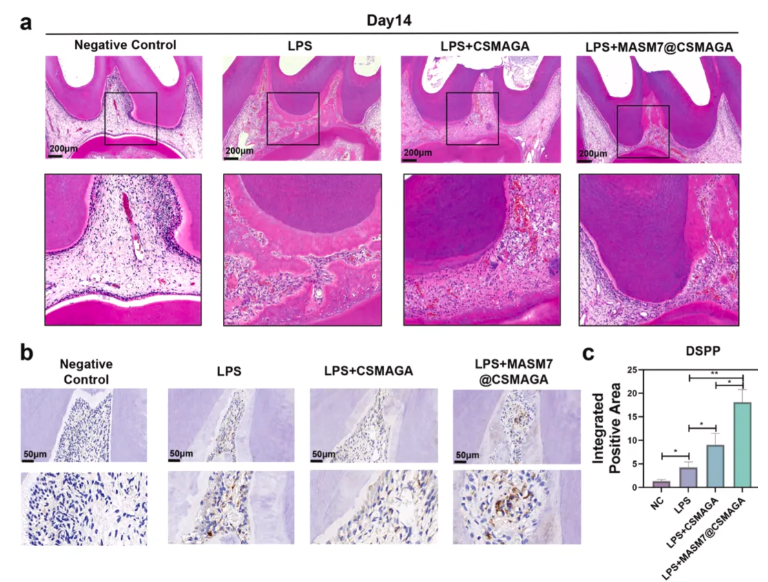
图7.MASM7@CSMAGA促进牙髓炎修复
研究总结
本研究开发了具有免疫调节和抗氧化能力的MASM7@CSMAGA水凝胶,该材料可加速牙髓炎后炎症牙髓组织的修复。MASM7通过促进线粒体融合,在炎症条件下促使THP-1-M型巨噬细胞向M2型极化转变,同时伴随代谢重编程——关键能量生成途径从糖酵解转变为OXPHOS。此外,经MASM7处理的THP 1 M细胞与牙髓干细胞共培养,可显著提升后者在炎症环境下的修复能力。CSMAGA水凝胶具备良好的可注射性与生物相容性,不仅能高效递送MASM7,还可通过清除活性氧发挥抗氧化作用。
靶标代谢流:基于稳定同位素示踪技术,聚焦糖酵解、TCA循环、PPP途径等关键代谢通路,可精准分析代谢物动态流量变化,实现代谢物高覆盖、高精准定量,助力揭示代谢通路活性、验证代谢调控机制,为生命科学研究及临床转化提供可靠数据支撑。









