

文章标题:From Clinical to Benchside: Lacticaseibacillus and Faecalibacterium Are Positively Associated With Muscle Health and Alleviate Age-Related Muscle Disorder
发表期刊:Aging Cell
影响因子:7.1
客户单位:香港中文大学
百趣提供服务:新一代代谢组学NGM 2 Pro、微生物16S扩增子测序、转录组测序
研究背景
肌肉减少症是老年常见病,患病率达10%-27%,与跌倒、骨折、死亡风险升高相关,现有运动与营养干预依从性差。新兴研究提示肠道菌群失衡可能通过 “肠-肌轴” 参与肌少症,例如:粪菌移植(Fecal Microbiota Transplantation, FMT)可逆转无菌小鼠肌肉萎缩;短链脂肪酸(Short-Chain Fatty Acids, SCFAs)等菌群代谢物能增强蛋白合成。老年肌少症患者与非肌少症者的肠道菌群组成存在差异,但两者的因果关系尚未明确。粪菌移植、益生菌等微生态制剂安全易用,或成为延缓肌肉衰老的新策略。在这项研究中,(i)比较了患有或不患有肌肉减少症的老年人的肠道微生物群组成和微生物代谢物,(ii)利用人类供体到受体小鼠的FMT来检测肌肉减少症与肠道微生物群之间的因果关系;(iii)为了进一步的临床转化,通过确认老年小鼠的疗效,确定了治疗肌肉减少症的潜在治疗细菌。
研究结果
1.老年肌少症与非肌少症者的肠道微生物群差异
为检测与肌少症相关的肠道微生物群及代谢物,本研究招募了51名老年人(年龄70.2±5.0岁,74.5%为女性),依据亚洲肌少症工作组(AWGS)2019共识,将其分为肌少症组(28人)和非肌少症组(23人)。
采用宏基因组测序技术,对比两组人群肠道微生物群的多样性及相对丰度。结果显示,两组的β多样性无显著差异(图1a)。通过线性判别分析(LDA)结合效应大小(LEfSe)分析发现,肌少症患者属水平上Paraprevotella、Butyricimonas virosa、Olsenella sp. oral taxon 807的相对丰度更高,而种水平上Prevotella sp. 885、Clostridium sp. ATCC 29733、Clostridiales bacterium VE202-27的相对丰度更低(图1b)。Metastats分析显示,在门、科、属、种各分类水平上,分别有10.1%、8.2%、10.4% 和 17.1%的微生物存在显著差异。此外,肌少症患者属水平的Lachnospira,以及种水平的Clostridiales bacterium KLE1615、uncultured Lachnospira sp.、Clostridiales bacterium_41_21_two_genomes和Ruminococcus sp. CAG90的丰度均显著降低(图1c)。
通过Spearman相关分析,进一步探究肠道微生物群丰度与老年参与者肌少症诊断相关肌肉指标的关联。结果表明,各分类水平下超过10%的微生物与肌肉健康相关。厚壁菌门(Bacillota)与肌肉量及握力呈正相关,而拟杆菌门(Bacteroidota)则呈负相关。在种水平上,聚焦已知益生菌与肌肉健康的关系以筛选副作用最小的菌株,发现16种益生菌中,鼠李糖乳球菌(Lacticaseibacillus rhamnosus, LR)与四肢骨骼肌质量指数(ASMI)呈正相关;普拉梭菌(Faecalibacterium prausnitzii, FP)与更好的运动性能呈正相关,而唾液乳杆菌(Ligilactobacillus salivarius)与运动性能呈负相关(图1d)。
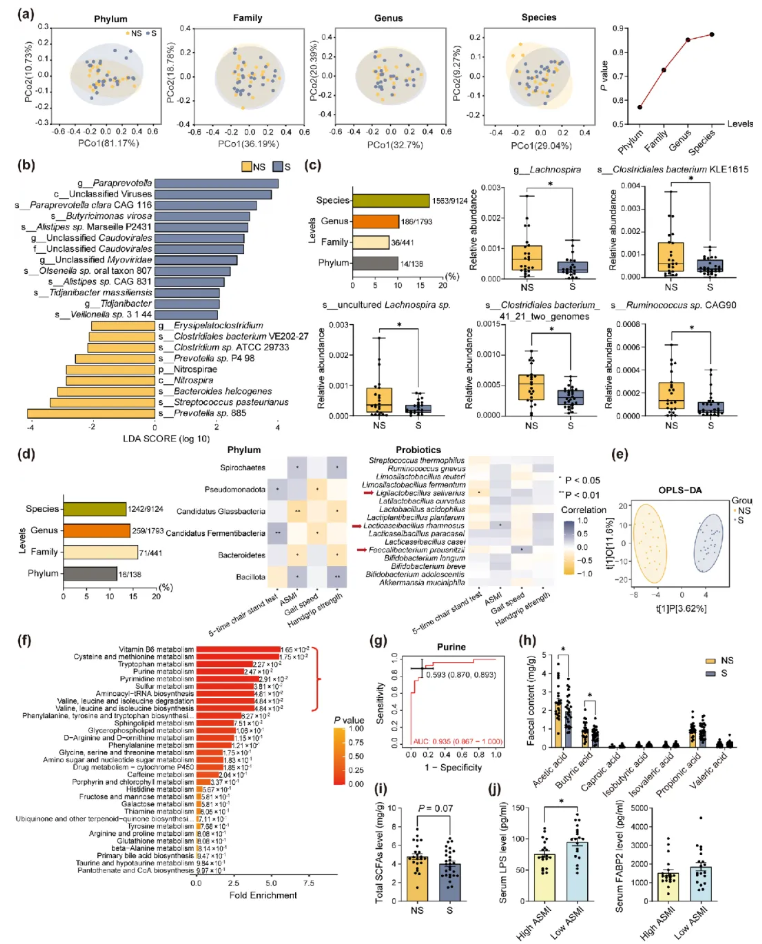
图1.老年肌少症患者的肠道微生物群及代谢物特征
2.老年肌少症与非肌少症者的肠道代谢物差异
采用液相色谱-质谱(LC-MS)技术进行代谢组学分析,检测两组人群的代谢物差异。通过正交偏最小二乘判别分析(OPLS-DA)发现,肌少症组与非肌少症组的粪便代谢物组成存在显著差异(图1e)。肌少症组中5-羟基己酸、熊去氧胆酸、色胺和嘌呤等32种微生物代谢产物显著上调,吲哚-2-羧酸等5种代谢产物显著下调。代谢物集富集分析(MSEA)表明,两组在维生素B6代谢、氨基酸代谢及嘌呤代谢通路中存在差异(图1f)。受试者工作特征(ROC)曲线分析显示,在37种差异代谢物中,嘌呤的曲线下面积(AUC)最高,是区分肌少症与非肌少症的潜在生物标志物(图1g)。
SCFAs是有益的肠道微生物代谢产物。研究发现,肌少症组的乙酸和丁酸水平显著降低,总SCFAs也呈现降低趋势(图1h-i)。血清脂多糖(LPS)和脂肪酸结合蛋白2(FABP2)可作为反映肠道屏障功能的生物标志物。由于髋部骨折患者肌少症患病率较高,对38名髋部骨折患者(年龄82.3±6.7岁,79%为女性)的分析显示,低ASMI组患者的血清LPS水平显著高于高ASMI组,而两组的FABP2水平无显著差异(图1j)。
3.肌少症患者粪便微生物移植(FMT)致受体小鼠肌肉损伤
尽管临床研究已证实肠道菌群组成与肌少症存在关联,但其因果关系尚未明确。本研究通过FMT实验探究二者因果关联,将抗生素预处理的小鼠分为两组,分别定植非肌少症者(FMT-NS组)和肌少症者(FMT-S组)的肠道菌群,同时设置未处理对照组(CTL组)和抗生素+磷酸盐缓冲盐水(PBS)灌胃对照组(PBS组)(图2a)。
基线时,各组小鼠的握力和体重无显著差异;经过2周抗生素处理后,小鼠的体重增长和力量提升受到抑制。持续12周干预后,与FMT-NS组相比,FMT-S组小鼠的肌肉湿重、前肢握力及肌肉收缩力(颤搐力、强直力)均显著降低,但两组的抗疲劳能力无明显差异(图2b-e);组织学与分子生物学检测显示,FMT-S组小鼠的肌纤维横截面积(CSA)最小,肌肉萎缩相关基因(murf1、mstn)mRNA表达显著升高,肌生成相关基因(myod)mRNA表达降低,但肌纤维类型比例与其他组无显著差异(图2f-g)。通过16S rDNA测序分析移植后小鼠的肠道菌群组成:α多样性(Chao1指数)显示,FMT-S组显著低于PBS组;β多样性分析显示,各组间存在显著差异(图2h)。
已知胃肠道疾病可诱发肌肉萎缩,肠道菌群可通过影响结肠健康调控肌肉状态。与FMT-S组相比,FMT-NS组小鼠的结肠隐窝长度更长,能分泌粘液保护肠道屏障的Muc2阳性细胞数量更多(图2i-j);尽管各组血清脂多糖(LPS)浓度无显著差异,但FMT-NS组的结肠紧密连接蛋白zo-1表达高于CTL组,且结肠组织中促炎因子il-1β的mRNA表达显著低于FMT-S组(图2k)。
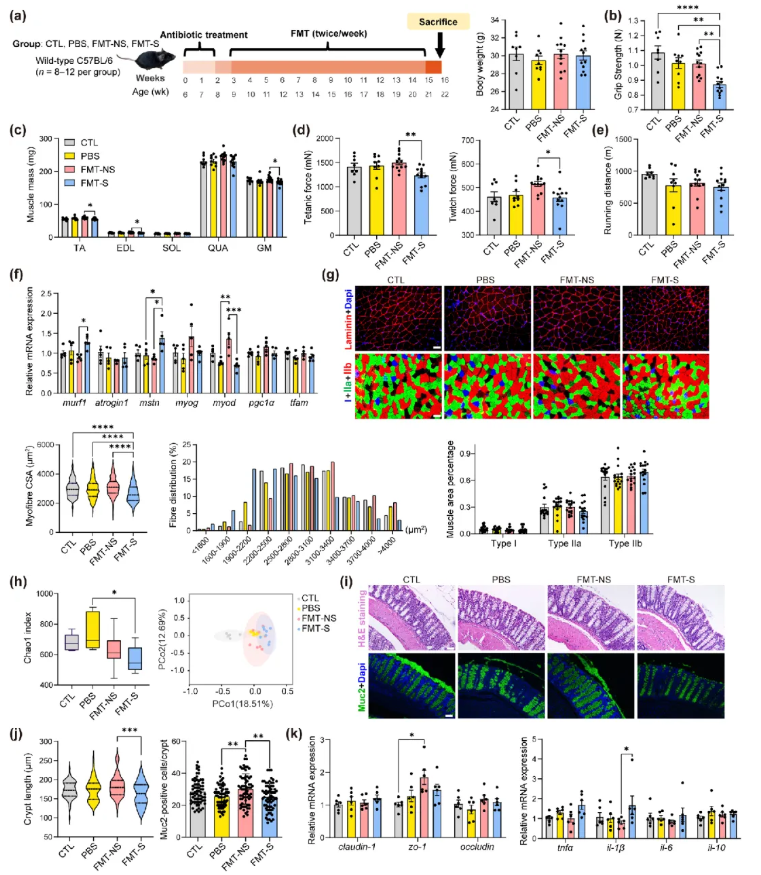
图2.FMT后肌肉减少症小鼠的肌肉、结肠和肠道微生物群的改变
4.益生菌治疗可改善肌肉质量、功能和肌纤维
肌少症患者的肠道微生物群会损害受体小鼠的肌肉状态,但非肌少症者的肠道微生物群并未给受体小鼠的肌肉健康带来更多益处。因此,寻找对肌肉健康有益的特定益生菌,对开发新型肌少症治疗方案至关重要。从临床结果来看,鼠李糖乳球菌(LR)是唯一与肌肉质量呈正相关的益生菌,普拉梭菌(FP)丰度与肌肉功能的正相关性强于唾液乳杆菌,且人体肠道中LR与FP丰度无显著关联。
本研究选用年龄匹配的老年小鼠,基线(20-21月龄)体重和握力无显著差异,干预3个月后各组体重仍具可比性(图3a)。益生菌治疗后,所有治疗组的股四头肌(QUA)和腓肠肌(GM)质量均有改善,胫骨前肌(TA)和比目鱼肌(SOL)质量仅在FP和LF(LR+FP混合菌)组增加,但体成分和标准化肌肉质量与对照组相当(图3b)。
抗疲劳分析显示,各治疗组腓肠肌(GM)抗疲劳能力较好,但LF组在480s后的抗疲劳能力与对照组相当(图3c)。小鼠的步态速度和自愿行走距离无显著差异(图3d)。
益生菌处理的小鼠肌纤维横截面积(CSA)更大;与对照组相比,三个益生菌处理组均显著降低了I型肌纤维的面积比例(图3e)。转录组分析显示,LR组富集三羧酸循环(TCA)、氧化磷酸化等通路,FP组以TCA循环富集最为显著,LF组则富集脂肪酸降解、TCA循环等通路(图3f)。
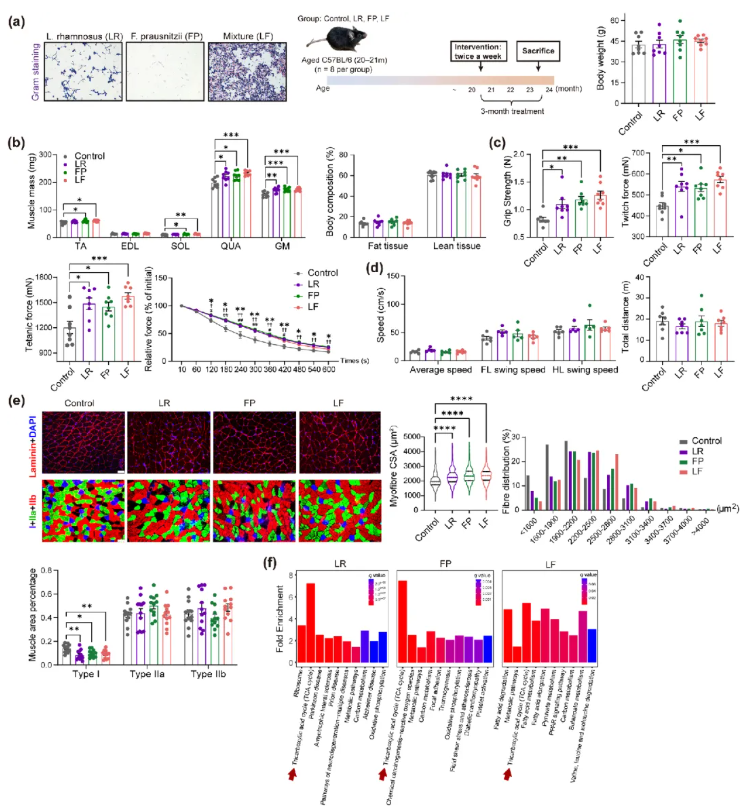
图3.益生菌干预老年小鼠后的肌肉质量、力量、体能表现、肌纤维结构及肌肉功能注释
5.益生菌通过增强肌肉线粒体功能改善肌肉健康
为明确益生菌对肌肉有益的作用机制,本研究进行了转录组测序(RNA-seq)。结果显示,鼠李糖乳球菌(LR)组的优势功能包括TCA循环、代谢途径和氧化磷酸化(OXPHOS);普拉梭菌(FP)组中TCA循环富集程度最高;混合菌(LF)组则主要富集脂肪酸降解、代谢途径及TCA循环相关功能(图3f)。
TCA 循环发生在线粒体基质中。动物实验中,老年小鼠肌肉线粒体密度低于其他组,且存在较多结构异常,表现为透明度较高、内膜褶皱减少(图4a)。ATP由线粒体中TCA循环及后续电子传递链的OXPHOS产生,与对照组相比,单独给予LR和FP处理的老年小鼠肌肉ATP含量显著升高(图4b)。衰老与NAD+/NADH比值降低相关,而LR和FP处理后,小鼠肌肉NAD+/NADH比值明显升高(图4c)。
总肌蛋白检测结果显示,线粒体融合蛋白OPA1在LR和FP组、MFN1在FP组、裂变蛋白DRP1在LR和FP组的表达均显著升高;LR组融合蛋白MFN2略有提高;脂肪酸氧化相关蛋白CPT1A仅在FP组较对照组升高;ATP5A1、COX IV等其他线粒体代谢相关蛋白在组间表达无显著差异。此外,FP和LF组线粒体生物发生蛋白NRF1表达较高,LR和FP组PGC1α表达显著升高(图4d)。益生菌治疗后线粒体功能的改善与肌肉健康的增强密切相关。
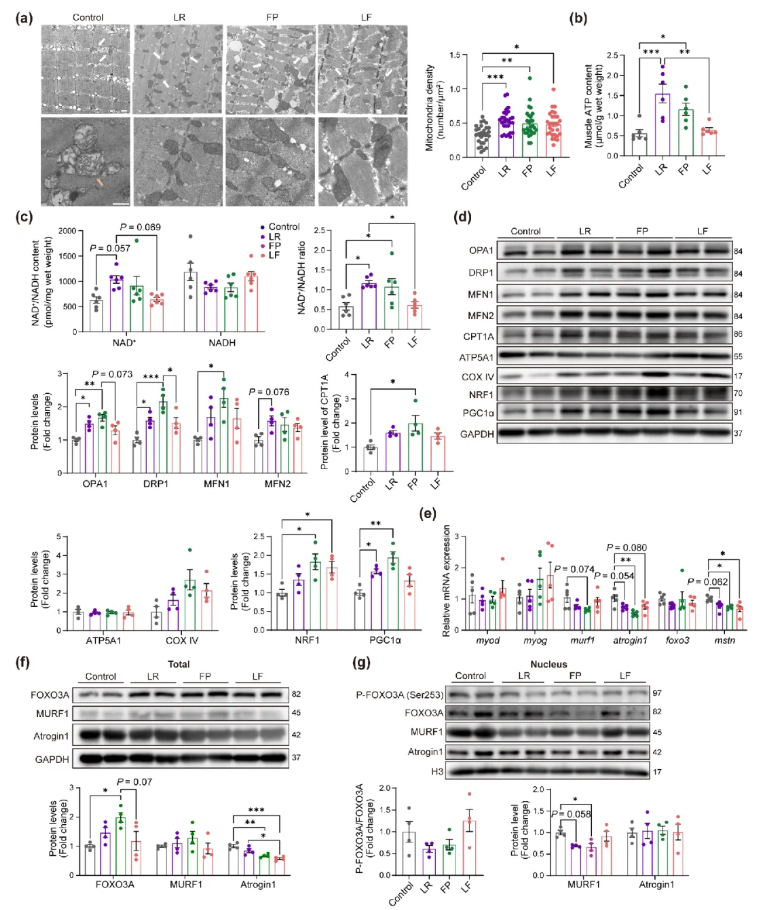
图4.益生菌干预老年小鼠后的线粒体密度、代谢及分子变化
6.益生菌可降低肌肉萎缩相关分子表达
肌少症与肌肉萎缩、肌发生障碍及神经肌肉连接(NMJ)功能障碍相关,因此本研究检测了相关基因与蛋白的表达水平。在mRNA水平上,FP组的肌萎缩相关基因atrogin1显著降低,LF组(LR+FP混合菌组)和FP组的肌抑素基因(mstn)表达水平较低;而肌生成相关基因myod、myog及转录因子foxo3的mRNA表达在各组间无显著差异(图4e)。在总蛋白水平上,与对照组相比,FP组小鼠的总FOXO3A蛋白表达升高;与对照组和LR组相比,FP组和LF组的Atrogin1蛋白表达显著降低(图4f)。
由于E3泛素连接酶受细胞核内FOXO3A调控,进一步检测了核蛋白表达:FP组显著降低了MURF1蛋白水平,LR组则呈现降低MURF1的趋势;细胞核中FOXO3A的激活水平与Atrogin1蛋白水平无显著差异(图4g)。
综上,FP对肌肉萎缩表现出明显抵抗作用,LF也能轻微降低萎缩标志物水平,但所有益生菌组均未影响肌肉肥大及NMJ功能相关生物标志物。
7.益生菌调节肠道菌群组成并改善肠道屏障,仅LR及LR+FP联合组可改善肠道免疫
肠道菌群与结肠健康可能是益生菌调控肌肉状态的中介。本研究通过16S rDNA测序及功能检测验证该假设,肠道菌群测序显示,α多样性(Shannon指数)仅LF组(LR+FP混合菌组)细菌丰富度显著增加(图5a);β多样性分析表明,3个益生菌治疗组(LR、FP、LF)与对照组菌群组成存在显著差异(图5b)。具体来看,FP和LR组阿克曼菌(有益菌)丰度升高,LF和FP组毛螺菌科NK4A136群丰度增加。功能注释显示,对照组氨基酸、脂质及维生素代谢水平低于治疗组,代谢性疾病相关功能丰度更高(图5c)。肠道屏障功能方面,益生菌治疗后E-钙粘蛋白(E-cadherin)和闭合蛋白(Occludin)表达显著升高,Claudin-1无明显变化(图5d)。
结肠免疫分析显示,LR和LF组CD8⁺IFNγ⁺T细胞数量较对照组减少(图5e),LR组结肠促炎细胞因子tnfα和il-1β显著降低(图5f),而各组结肠组织结构无差异(图5g)。
综上,益生菌可优化肠道微生物组结构、提升肠道屏障功能,其中LR能有效缓解结肠炎症与免疫紊乱,LF对菌群多样性及结肠免疫有改善作用,进一步佐证肠-肌肉轴的中介作用。
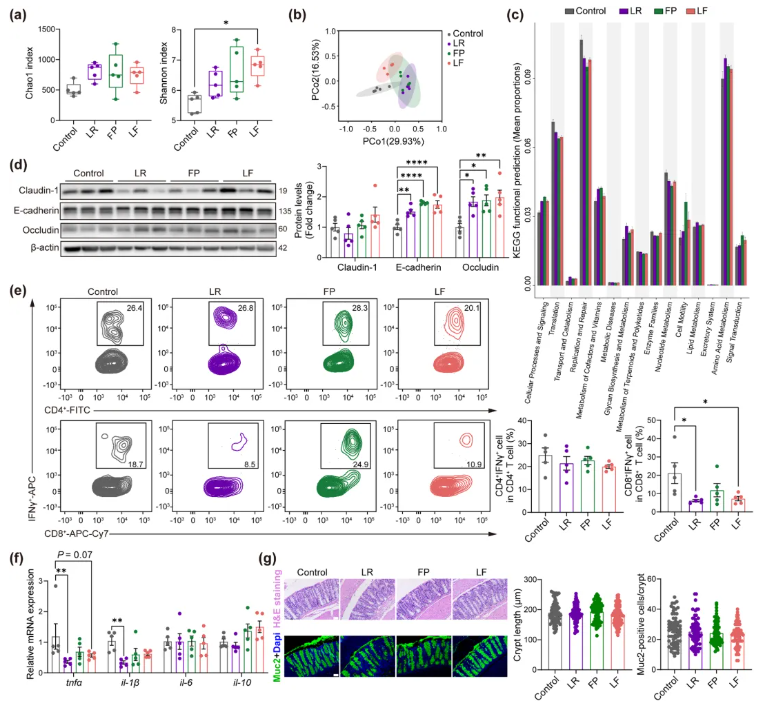
图5.益生菌处理老年小鼠肠道微生物多样性与结肠健康
研究总结
临床与动物实验联合证明,肌少症患者肠道鼠李糖乳球菌(Lacticaseibacillus rhamnosus)和普拉梭菌(Faecalibacterium prausnitzii)显著减少;补充两株菌可恢复老龄小鼠肠道屏障,抑制结肠CD8⁺IFN-γ⁺细胞介导的炎症反应,增强线粒体生物发生与TCA循环,显著提高肌肉量、肌纤维面积和握力,证实其通过 “肠-肌轴” 缓解年龄相关肌肉衰退,并具备直接临床转化潜力。
百趣生物新一代代谢组学NGM 2 Pro:凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。
微生物16S扩增子测序:基于二代测序平台靶向扩增微生物16S rRNA基因可变区,可高效解析样本中细菌 / 古菌的群落组成、物种丰度及分布差异;其通过提取样本总DNA、靶向扩增目标片段、高通量测序等关键步骤快速获取菌群结构信息,广泛应用于肠道、土壤等各类含微生物样本研究,能为探究微生物与环境、宿主的互作关系(如肠道菌群与疾病、土壤菌群与作物生长)提供关键数据支撑。
转录组测序:对细胞或组织在某一状态下的全部RNA进行测定,凭借新一代高通量测序技术,它能快速获取海量转录本序列,精准识别可变剪接、新转录本等关键信息。无论是助力基础研究探索基因功能,还是为临床诊断提供分子层面依据,转录组测序都是强有力的科研工具,为解锁生命奥秘、攻克健康难题带来更多可能 。









