英文标题:In-depth organic mass cytometry reveals differential contents of 3-hydroxybutanoic acid at the single-cell level
中文标题:深度有机质谱流式细胞术揭示单细胞水平3-羟基丁酸的含量差异
发表期刊:nature communications
影响因子:14.7
研究背景
在生命科学研究中,细胞代谢过程是理解生命活动的核心环节之一。单细胞代谢组学聚焦于单个细胞内的代谢物,能够精准揭示细胞在不同状态下的代谢特征,对于阐释细胞表型异质性、解析生物过程分子机制意义重大。
肿瘤细胞的代谢重编程为其恶性行为提供了物质和能量支持,是肿瘤发展的关键因素。因此,明确肿瘤细胞代谢特征,进而阻断其异常代谢途径,成为极具潜力的肿瘤治疗策略。然而,肿瘤细胞代谢存在显著异质性,传统代谢组学方法只能获取细胞群体的平均信息,无法展现单细胞间的差异,这给基于代谢的抗癌治疗带来了巨大挑战。单细胞代谢组学则可通过质谱等技术检测单个细胞代谢物,为肿瘤代谢靶点筛选提供更精准依据。
尽管单细胞代谢组学发展迅速,但仍面临一系列技术瓶颈。单细胞的高效分离、代谢物的有效提取与实时检测,以及检测技术在多指标和高灵敏度方面的提升都颇具挑战。同时,现有方法在单细胞分析时,存在鉴定深度不足的问题,分析时间短导致难以获得二级质谱信息,且同分异构体的区分也较为困难。这些问题严重限制了单细胞代谢组学在基础研究和临床应用方面的进一步发展。因此,开发能够突破这些限制的新技术和新方法,对深入探究单细胞代谢奥秘、攻克肿瘤治疗难题具有重要的现实意义。
研究结果 1、深度有机质谱流式细胞术的构建与性能 研发背景 电喷雾电离质谱(CyESI)或有机质谱流式细胞术中,单细胞质谱数据采集时间短,限制了代谢物信息的准确识别和解析。当前单细胞代谢物鉴定方法存在不确定性,因此需要高效的在线细胞裂解和充足分析时间。 系统构成 在团队之前构建的有机质谱流式细胞术平台基础上,开发了ID-organic cytoMS,配备高效在线裂解系统和高分辨率非接触式ESI-MS(图1)。MCF-7细胞悬浮于140 mM甲酸铵溶液,经迪恩流在排序毛细管实现单细胞分选,与鞘液混合后,通过低能量超声和冰浴条件实现在线细胞裂解,添加特定鞘液提高电离效率和细胞裂解性能。裂解物经自制直流非接触式ESI电离,由高分辨率轨道阱质谱仪分析。 性能优势 (1)延长分析时间:成功延长单细胞MS数据采集窗口,与之前方法相比,从0.6秒延长至25秒,提升超过40倍(图2b),是目前文献中最长的在线MS检测窗口,有助于获取足够的MS/MS数据用于代谢物鉴定。 (2)增加质谱峰数量与提升分辨率:在负模式和正模式下分别检测到534个和1285个特征质谱峰(图2c),主要峰与脂肪酸代谢等相关。以质荷比130.0868的质谱峰为例,280,000的质量分辨率比35,000的质量分辨率得到的质谱峰半峰宽窄,提高了代谢物鉴定准确性。 (3)验证单细胞分离与信号来源:用核染料Hoechst 33342和膜染料DIO染色验证单细胞分离,超声处理后细胞结构被破坏。细胞特异性脂质的提取离子色谱图显示正态分布信号,且该信号源自细胞事件(图2a),同时证实了脉冲信号与单个细胞事件一一对应。 参数优化 对细胞悬液密度、鞘液流速等参数进行优化,选择添加1%氨溶液或1‰甲酸的甲醇作为鞘液,确定约7000个细胞/mL的细胞悬液和10 μL/min的鞘液流速用于后续实验,其他参数依据文献优化。采用非接触式冰浴超声处理,防止外部干扰和内源性化合物降解,实现单细胞连续裂解,为单细胞代谢组学研究提供有力工具。 图1. 深度有机质谱流式细胞术(ID-organic cytoMS)的工作流程 图2. ID-organic cytoMS的验证 2、利用二级质谱(MS2)对单细胞代谢物进行深度分析 ID-organic cytoMS平台通过延长单细胞分析时间,实现了单细胞内MS2数据采集,为代谢物结构解析与种类鉴定提供了新途径。 技术原理与数据采集 采用TopNddMS2(n=7)模式连续采集单细胞代谢组数据,构建高分辨率MS/MS数据库。离散离子色谱图(图3a)显示全MS与MS/MS谱图的强度差异,单个MCF-7细胞的己酸代谢物MS2谱图(图3b)清晰呈现碎片离子特征。通过该模式,单个细胞平均完成300次ddMS2采集,鉴定出150种代谢物(图3c)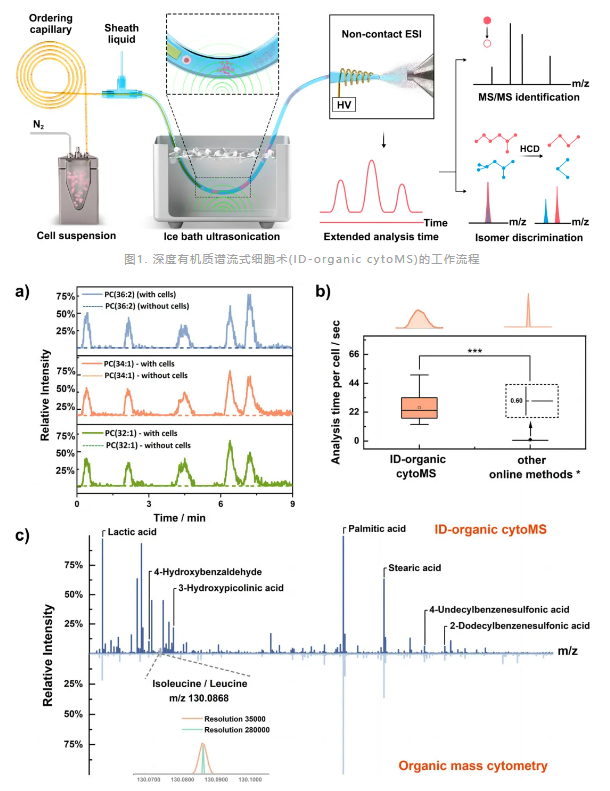
代谢物鉴定规模 在单细胞中实现目前最大规模的代谢物鉴定,负模式和正模式分别识别出224种(如羧酸、氨基酸)和348种(如脂肪酸、脂质)代谢物。
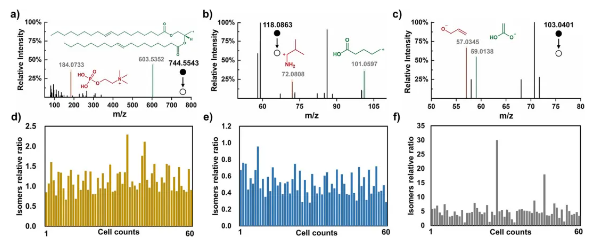
功能注释与意义 KEGG注释表明这些代谢物主要参与基础能量代谢、膜转运等细胞过程(图3d)。平台通过充足的MS2采集时间与高细胞通量,支持代谢物结构推测与同分异构体区分,为解析细胞代谢异质性提供了关键工具。 图3. 单细胞水平基于MS2的代谢物分析 3、基于ID-organic cytoMS平台的MCF-7细胞异构体精准解析 在单细胞分析中,同分异构体鉴别较代谢物鉴定更具挑战性。ID-organic cytoMS平台通过在线细胞裂解与延长分析时间获取充足MS2数据,实现了结构异构体的精准区分。 异构体鉴别实例 基于独特MS/MS光谱,成功区分3对异构体(图4a-c):PC(15:1_18:1)与PE(18:1_18:1)(m/z 744.5543),诊断离子对为m/z 184.0733与 603.5352;5-氨基戊酸与缬氨酸(m/z 118.0863),诊断离子对为m/z 72.0808与101.0597;4-羟基丁酸(4-hydroxybutanoic acid, GHB)与3-羟基丁酸(3-hydroxybutanoic acid, BHB)(m/z 103.0401),诊断离子对为m/z 57.0346与59.0138。 相对定量与异质性 60个单细胞中,BHB与GHB的相对丰度比差异显著(图4d-f),其异质性幅度大于其他异构体对;随机12个细胞的m/z 103.0401 MS2光谱显示个体间差异。 特异性验证与机制启示 BHB标准品在不同碰撞能量下的MS2光谱证实诊断离子特异性,提示MCF-7细胞中BHB/GHB通路存在显著代谢异质性,其功能机制需进一步研究。 图4. 单细胞水平异构体的定性和定量分析 4、使用BHB/GHB异构体对MCF-7细胞进行精细分型 在验证ID-organic cytoMS的传统细胞分型能力后,研究进一步探索了异构体对的分型潜力。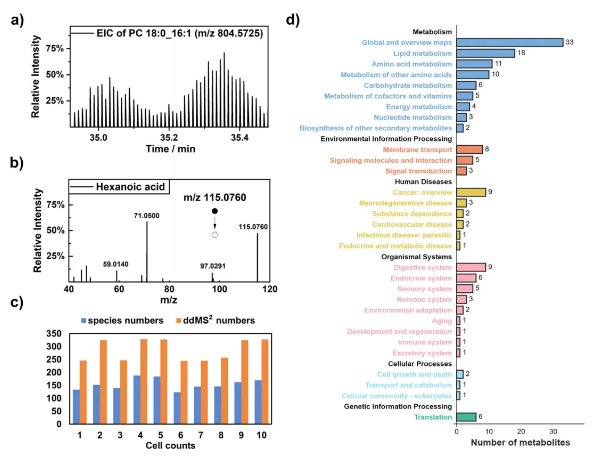
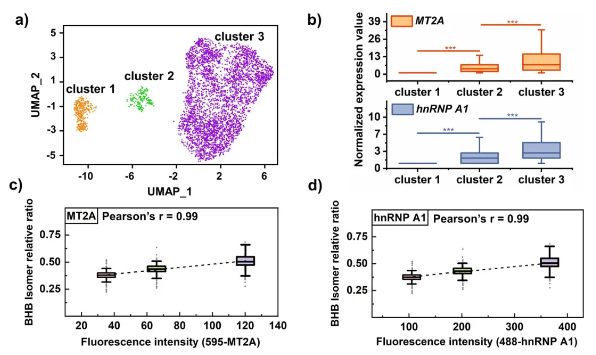
传统细胞分型验证 基于非异构体代谢物丰度,通过t分布随机邻域嵌入 (t-distributed stochastic neighbor embedding, t-SNE)成功区分MCF-7、MDA-MB-231、HeLa和HepG2四种肿瘤细胞(图5a),单细胞代谢物热图显示细胞类型间显著代谢异质性。
MCF-7细胞内部分型突破 (1)单一代谢物数据的局限性:仅基于非异构体代谢物时,MCF-7细胞内部无明显聚类(图5b)。 (2)BHB/GHB异构体的关键作用:结合BHB/GHB异构体信息后,MCF-7细胞被清晰分为3个簇(图5b),且3簇间BHB/GHB相对比例差异显著(图5c)。其他两对异构体(如PC/PE、5-氨基戊酸/缬氨酸)无法实现亚型细分。 代谢异质性的特征 簇间代谢物丰度无显著差异,表明BHB/GHB异构体比例是MCF-7细胞亚型区分的特异性标志物,而非整体代谢物水平变化。生物学意义:MCF-7细胞(乳腺肿瘤来源,以管腔A型为主)的单细胞异构体分型,首次揭示其内部代谢异质性,为乳腺癌精准治疗中细胞亚型细分提供了新方法,有助于理解肿瘤异质性与治疗响应差异。 图5. 基于BHB/GHB异构体信息的MCF-7细胞聚类分析 5、MCF-7细胞中BHB的多组学数据解读 研究通过单细胞转录组测序(10373个MCF-7细胞)与代谢组学联合分析,揭示BHB丰度差异的分子机制及功能关联。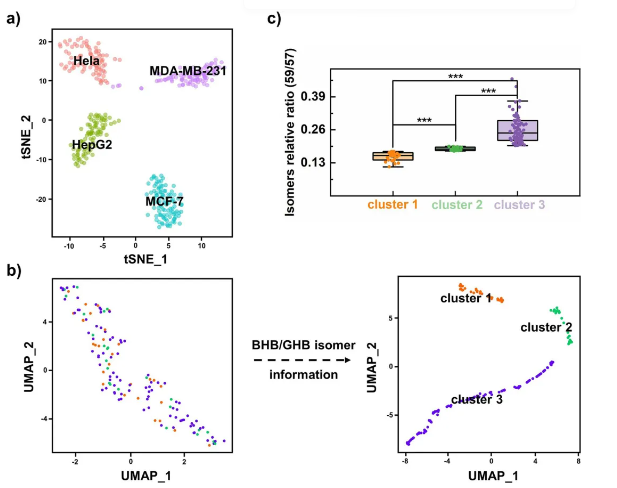
转录组与代谢组学的一致性验证 (1)细胞簇对应关系:单细胞转录组数据显示MCF-7细胞分为3个簇(图6a),与基于BHB/GHB的代谢组学分型结果完全一致,证实代谢异质性由转录水平驱动。 (2)GHB代谢通路的排除:分析GHB相关酶(PON3、AKR7A2、ALDH5A1)的基因和蛋白表达,发现簇间无显著差异,提示细胞簇区分主要归因于BHB丰度差异,而非GHB。 BHB的信号调控功能解析 (1)抗氧化应激通路的核心作用:BHB作为组蛋白去乙酰化酶(Histone Deacetylase, HDAC)抑制剂,显著上调抗氧化因子MT2A的转录,其表达在3个簇间差异显著(图6b)。异质核糖核蛋白hnRNP A1(与BHB直接结合并参与氧化应激保护)的表达也呈现簇间差异(图6b)。通过荧光激活细胞分选技术(Fluorescence-Activated Cell Sorting, FACS)分选MT2A/hnRNP A1高表达细胞,证实其BHB丰度显著更高,且两者呈强正相关(图6c-d)。 (2)多通路协同作用:其他BHB靶基因(如SOD、SULT2B1、GATA3)在抗氧化、肿瘤抑制和细胞衰老通路中差异表达,表明BHB通过多信号网络调控癌细胞功能。 BHB的能量代谢功能排除 代谢灵活性缺失的证据:单细胞代谢组学显示,三羧酸循环和脂肪酸代谢相关代谢物丰度与BHB含量无相关性,结合线粒体异常的文献报道,证实癌细胞无法利用BHB作为替代能源,其功能以信号调控为主。 通路富集与潜在机制延伸 (1)KEGG通路分析:氧化磷酸化通路及神经退行性疾病相关通路(如帕金森病、阿尔茨海默病)显著富集,与BHB的表观调控和神经保护功能一致。 (2)新调控因子的发现:差异表达基因(如长链非编码RNA KCNQ1OT1、NEAT1)可能参与BHB介导的信号转导,其中NEAT1在HDAC抑制耐受细胞中上调,提示与BHB抗氧化作用的潜在关联。 本研究首次在单细胞水平整合代谢组学与转录组学,揭示BHB作为代谢-转录交叉调控因子的角色。证实BHB异质性驱动MCF-7细胞功能亚型分化,且其作用独立于能量代谢,为乳腺癌抗氧化治疗和精准分型提供了靶点(如MT2A、hnRNP A1)。 图6. 10x Genomics单细胞转录组测序验证 研究结论 本研究通过单细胞代谢组学与转录组学联合分析,发现乳腺癌细胞MCF-7中BHB/GHB异构体比例差异可驱动细胞分为3个功能亚型,结合转录组验证及FACS分选实验,证实BHB丰度通过表观调控显著影响抗氧化因子MT2A、hnRNP A1等靶蛋白表达,且其作用与能量代谢无关;通路富集分析显示氧化磷酸化及神经退行性疾病相关通路显著富集,与BHB的表观调控和神经保护功能一致。该研究首次在单细胞水平揭示BHB介导的肿瘤细胞异质性机制,为乳腺癌精准分型及靶向抗氧化通路治疗提供了新依据。