

英文标题:GPR25 promotes the formation of lung and liver tissue- resident memory CD8 T cells
中文标题:GPR25促进肺和肝组织——常驻记忆CD8 T细胞的形成
发表期刊:Science Immunology
影响因子:16.3
研究背景
组织驻留记忆CD8 T(TRM)细胞提供关键的抗病毒和抗肿瘤免疫,但指导其发展的分子途径尚未完全确定。
研究团队发现G蛋白偶联受体GPR25是由转化生长因子-β(TGF-β)信号诱导的TRM细胞形成的调节剂。研究结果表明,调节GPR25功能可能为改善感染和癌症中的TRM细胞反应提供一种治疗策略。
研究结果
01-TGF-β诱导CD8 T细胞中GPR25的表达
免疫细胞表达、eQTLs和表观基因组学数据库的分析证实,与非TRM细胞亚群和循环CD8 T细胞亚群相比,GPR25和TRM细胞相关基因在肺TRM细胞中显著富集(图1A-B)。TGF β处理可快速诱导原代人CD8 T细胞中GPR25的表达,这些细胞通过抗CD3和抗CD28 抗体在体外多克隆激活(图1C)。与非TRM细胞相比,GPR25转录起始位点上游的三个区域(C1、C2和C3),在肿瘤浸润性TRM细胞中显示出突出的转座酶可及峰(ATAC-seq峰),表明GPR25的表达可能受到这些信号通路的共同调节(图1D)。
与在人T细胞中观察到的类似,在体外通过TCR和CD28交联激活的小鼠CD8 T细胞中,TGF-β有效诱导Gpr25的表达,但其表达水平随时间逐渐下降(图1E)。此外,在未处理的野生型C57BL/6小鼠中,表达 TRM细胞标记物CD69的小肠上皮内淋巴细胞(siIELs)和肝脏 T细胞等非淋巴器官中的CD8 T细胞表达更高水平的Gpr25转录物,而脾CD8 T细胞显示出最小的Gpr25表达(图1F)。因此,在小鼠和人类中,GPR25是TGF-β诱导基因,在TRM细胞中选择性表达。
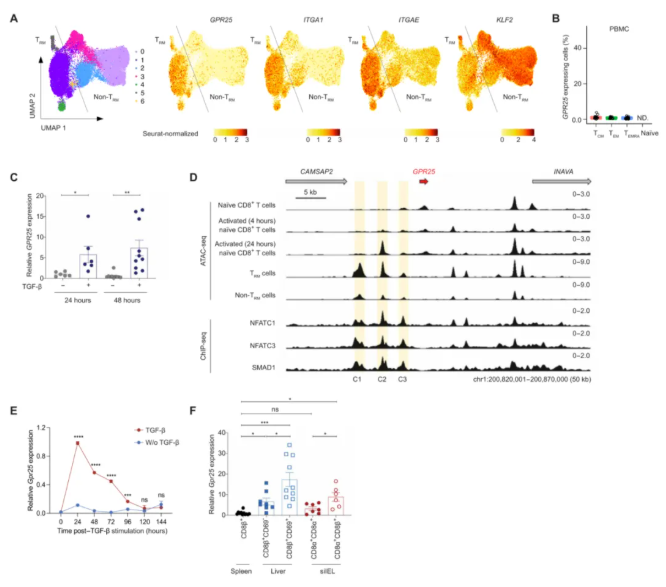
图1.TGF-β诱导GPR25在CD8 T细胞中的表达
02 -GPR25促进肝脏TRM细胞的发育和维持
为评估GPR25在TRM细胞发育中的相对作用,在感染90天后比较脾脏、肝脏和siIEL室中转移的T细胞的细胞频率和记忆表型(图2A),发现相同比例的GPR25-WT和GPR25-KO OT-I T细胞(图2B)。正如预期的那样,肝脏TRM细胞(CD69+)共表达CXCR6,但缺乏CD103的表达,GPR25-WT和GPR25-KO OT-I T细胞在siIEL室中TRM细胞的频率没有显著差异(图2C),这表明Gpr25对于siIEL室中TRM细胞的发育是不可缺少的。
使用异体共生实验来评估GPR25-WT和GPR25-KO肝脏TRM细胞的驻留潜力(图2D)。共生30天后,GPR25-WT和GPR25-KO OT-I T细胞在宿主肝脏中以相同比例积累,但在CD8-KO配对受体小鼠的脾脏中观察到GPR25-KO OT-I T细胞与GPR25-WT OT-I T细胞的比例明显更高(图2E)。因此,组织中缺乏GPR25的T细胞表现出降低的驻留潜力,更有可能重新进入循环,这表明GPR25支持肝脏TRM细胞的发育。
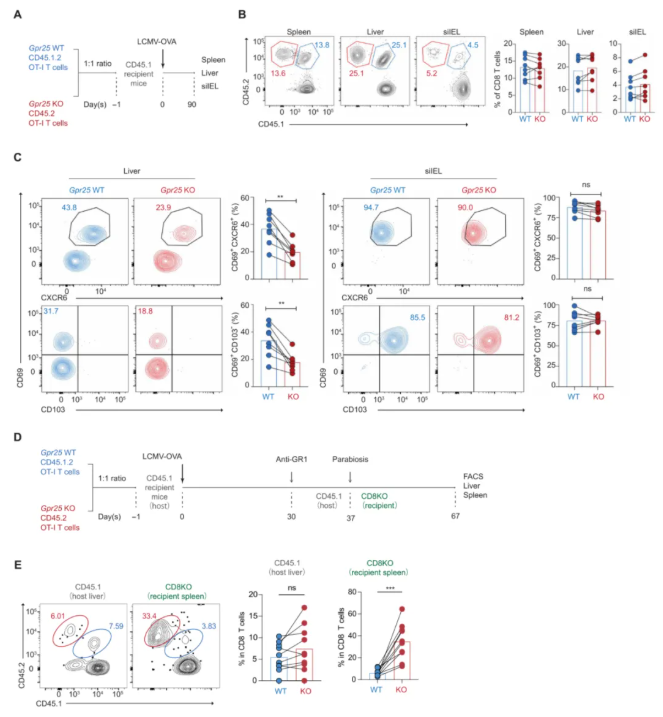
图2.GPR25促进肝脏TRM细胞的发育
03 -Gpr25缺乏会损害TRM细胞发育的早期阶段
为评估GPR25是否影响TRM细胞发育的早期阶段,通过比较比较LCMV-OVA感染后肝脏中过继共转移GPR25-WT和GPR25-KO OT-I T细胞在早期时间点的表型(图3A),感染后的48小时内观察到细胞的激活和增殖状态没有差异(图3B),感染后的第5天、12天和30天,细胞的比例相等,Gpr25缺乏对肝脏中转移的OT-I T细胞的KLRG1+效应表型没有可测量的影响,少量转移的OT-I T细胞共表达肝脏TRM细胞标志物CD69和CXCR6。
然而,在感染后第12天观察到肝脏中存在明显的CD69+CXCR6+OT-I T细胞群,表明潜在的TRM前体细胞的形成(图3C-E)。Gpr25缺陷导致这些TRM前体细胞减少,肝脏中KLRG1+效应细胞相应增加(图3D)。然而,脾脏中CD69+CXCR6+ OT-I T细胞的频率非常低,GPR25-WT和GPR25-KO OT-I T细胞在任何时间点上均无显著差异(图3E)。这些发现表明,gpr25缺陷T细胞产生肝脏TRM细胞的受损不太可能是由于脾脏TRM前体细胞频率的改变。
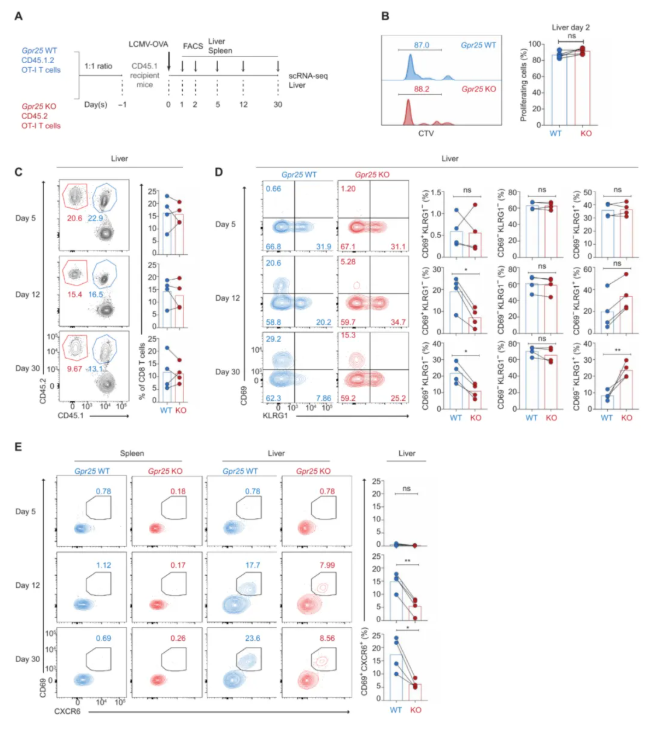
图3.Gpr25缺乏损害TRM细胞发育的早期阶段
04 -GPR25支持干细胞样TRM细胞的产生
差异基因表达分析显示肝脏GPR25-WT和GPR25-KO TRM细胞的转录谱存在显著差异(图4A)。与GPR25-KO TRM细胞相比,GPR25-WT TRM细胞对干细胞样T细胞特征表现出阳性富集,对效应物相关特征的富集程度降低(图4B)。对肝脏组织驻留记忆T细胞(TRM)进行无监督亚群分析,发现存在异质性亚群:主要簇1和3富含干细胞样特征及相关基因(Tcf1和Lef1),而簇0和2则富含效应基因(如Klrg1、Prf1、Gzma、Gzmb和GzmK)(图4C-E)。RT-qPCR和细胞内染色证实,GPR25-WT中TCF1编码的转录本和TCF1蛋白水平高于GPR25-KO肝TRM细胞(图4F-G)。
使用继发性转移方法来确定Gpr25缺陷是否影响肝脏中继发性TRM细胞的产生(图4H)。感染30天后观察到肝脏中转移的GPR25-WT和GPR25-KO OT-I T细胞数量大致相等(图4I),表明GPR25-KO TRM细胞在肝脏中迁移和产生记忆T细胞的能力没有重大缺陷。
然而,与GPR25-WT TRM细胞相比,GPR25-KO TRM细胞在肝脏中分化为继发性TRM细胞(CD69+CXCR6+)的频率显著降低(图4J)。
相比之下,效应记忆T细胞(TEM)(KLRG1+CD62L−CD69−)的频率增加(图4K)。这些结果表明,GPR25-KO TRM细胞在抗原再激发后分化为次级TRM细胞的能力存在缺陷。
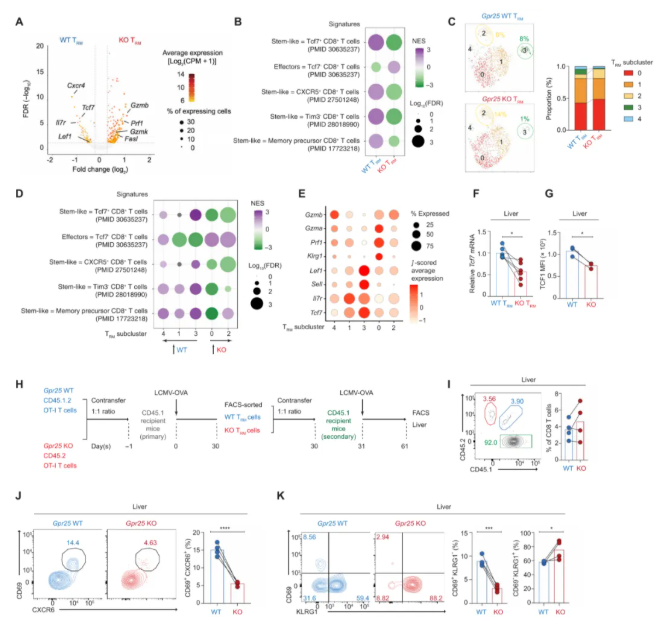
图4.GPR25促进干细胞样TRM细胞的发育
05 -GPR25增强T细胞对TGF-β的应答
与受体小鼠肝脏中的GPR25-KO TRM细胞相比,GPR25-WT TRM细胞中TGF-β特征基因正富集(图5A)。缺乏TGF-β受体29(Tgfbr2)的表达没有改变,但在肝脏TRM细胞中TGF-β受体1(Tgfbr1)的表达增加(图5B)。评估TGF-β信号在LCMV病毒感染模型中的作用(图5C)。阻断TGF-β信号通路在LCMV-OVA感染前后30天显著减少了肝脏中过继转移的CD69+CXCR6+的OT-1T细胞的频率,而不改变第30天时在肝脏中积累的OT-1T细胞的总数(图5D)。研究发现,与GPR25-WT CD8 T细胞相比,GPR25-KO细胞中磷酸化的SMAD2和SMAD3蛋白(pSMAD2/SMAD3)的表达水平显著降低(图5E)。
此外,在CD8 T细胞中过表达Gpr25则表现出更高水平的pSMAD2/SMAD3(图5F)。利用已发表的来自体外TRM细胞分化模型的RNA-seq数据集首次发现维甲酸(retinoic acid,RA)不会诱导T细胞中Gpr25的表达,而是抑制TGF-β诱导的Gpr25的表达(图5G)。接下来,在这个体外模型中评估了RA是否可以在缺乏Gpr25的情况下驱动TRM细胞分化(图5H)。正如预期的那样,与GPR25-WT T细胞相比,在TGF-β处理的条件下,GPR25-KO CD8 T细胞向CD69+CD103+TRM样细胞的分化受损(图5I)。
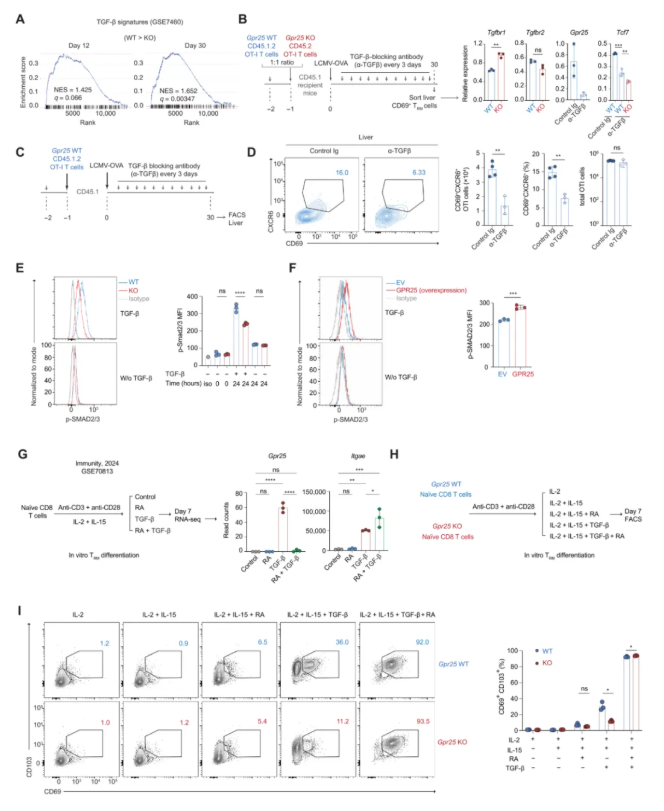
图5.GPR25增强T细胞对TGF- β的应答
06 -GPR25促进肺TRM细胞的发育
采用LCMV-OVA感染幼稚CD45.1受体小鼠(图6A),在肺中观察到GPR25-WT和GPR25-KO OT-I T细胞的比例大致相等(图6B)。感染30天后,在肺部检测到不同的CD69+CD103+OT-ITRM细胞群,与Gpr25充足的OT-I T细胞相比,缺乏Gpr25的OT-I T细胞在肺部发育为CD69+CD103+TRM细胞的能力降低(图6C)。
为进一步了解GPR25促进肺中CD69+CD103+TRM细胞发育的机制,通过对GPR25-WT和GPR25-KO OT-I记忆T细胞进行了单细胞转录组分析,OT-I T细胞分为两个主要亚群,在第0簇中观察到GPR25-WT与GPR25-KO OT-I记忆T细胞的比例更大(图6D)。与在肝脏TRM细胞中的发现类似(图4A-D),富含GPR25-WT T细胞的第0簇细胞相对于第1簇显示出效应相关基因表达减少,而干细胞样标记的表达增加(图6E-F)。此外,簇0显示出TRM细胞特征的强富集(图6G),表明它主要由TRM细胞组成,与簇1相反(图6D)。为验证这些发现,通过GPR25-WT和GPR25-KO OT-I T细胞将CD8-KO受体小鼠分成不同的队列,然后用LCMV-OVA感染它们(图6H)。如预期那般,在转移的GPR25-WT OT-I T细胞中,肺中TCF1+CD69+ CD8 T细胞的频率明显高于GPR25-KO OT-I T细胞(图6I)。通过RT-qPCR分析证实,LCMV感染后第30天,GPR25-KO OT-I细胞中的Zeb2和S1pr5转录物水平显著升高(图6J)。
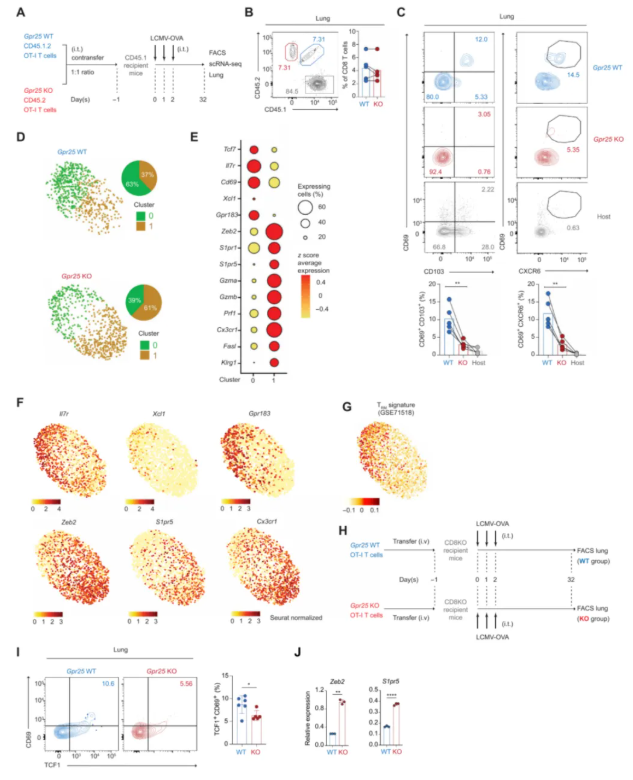
图6.GPR25促进肺TRM细胞的发育
07 - Gpr25缺陷T细胞不能控制肺转移
为评估Gpr25缺陷记忆T细胞是否在肿瘤攻击模型中表现出受损的继发性肺T细胞反应,按图6A所示,感染30天后使用B16F10-OVA肿瘤细胞刺激受体小鼠以诱导转移(图7A)。接种13天后,GPR25-WT OT-I细胞在肺中的出现频率显著高于GPR25-KO OT-I细胞(图7B)。因此假设Gpr25-充足的OT-I记忆T细胞具有更大的控制肺转移的能力。为验证该假设,两组独立的CD45.1 WT受体小鼠(图 7C)分别接受GPR25-WT OT-I T细胞或GPR25-KO OT-I T细胞输注,随后经气管内感染LCMV-OVA。感染30天后使用B16F10-OVA细胞进行激发,并在FTY720处理后评估肺转移程度。结果显示,与接受GPR25-KO OT-I细胞的小鼠相比,接受GPR25充足的OT-I细胞的小鼠的转移结节数量显著减少(图7D)。
为排除宿主CD8 T细胞的干扰,采用CD8-KO小鼠作为受体,验证GPR25-WT OT-I T细胞与GPR25-KO OT-I T细胞在控制肺转移中的作用(图 7E)。对照组设置为未接受T细胞输注的CD8-KO小鼠,以专门评估过继转移OT-I T细胞的作用。结果显示,接受GPR25-KO OT-I T 细胞的CD8-KO小鼠存活结局较差,死亡率达50%;而接受GPR25-WT OT-I细胞的CD8-KO小鼠在分析时大多数存活(图7F)。此外,与接受GPR25-KO OT-I细胞或不转移OT-I细胞的CD8-KO小鼠相比,接受GPR25-WT OT-I细胞的CD8-KO小鼠的转移结节数量显著减少(图7G)。
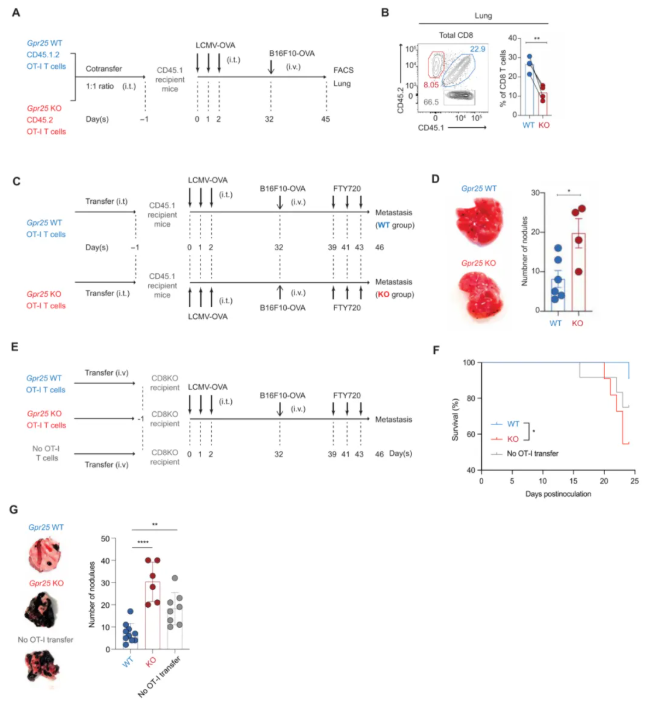
图7.Gpr25缺陷T细胞不能控制肺转移
研究总结
在转录组学调查中,与非TRM细胞相比,GPR25成为肺和肿瘤浸润性CD8 TRM细胞中差异表达最多的基因之一。
研究发现GPR25在人CD8 T细胞中通过TGF-β信号诱导表达。LCMV感染模型证明了GPR25在支持小鼠肝脏和肺中表达TCF1的干细胞样TRM细胞的发育中发挥关键作用,而不是在siIEL室发育的干细胞。使用TRM生成的其他组织特异性模型的未来研究可用于检查GPR25在组织室中的作用。鉴于TRM细胞在抗肿瘤免疫应答中的重要性,推断通过靶向GPR25活性来调节TRM细胞应答的方法可能在相关的临床环境中有希望。
单细胞转录组测序:是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。









