
英文标题:O-GalNAc glycans are enriched in neuronal tracts and regulate nodes of Ranvier
发表期刊:PNAS
影响因子:9.1
研究背景
O-糖基化是大脑中一种关键的修饰,其通路中的遗传变异与常见及严重的神经精神表型相关。然而,对于哺乳动物大脑中最丰富的O-聚糖——N-乙酰半乳糖胺连接的聚糖(O-GalNAc),人们知之甚少。糖基化作为将聚糖酶促连接到蛋白质和脂质上的过程,会产生大量非模板化的生物分子,参与健康与疾病过程,在大脑中,糖基化对正常发育和功能至关重要,几乎影响包括突触可塑性、离子通道功能和轴突导向等所有过程。
在大脑中,多数关于糖基化的研究集中在糖脂和天冬酰胺连接N-糖蛋白上,而对连接到丝氨酸、苏氨酸(偶尔还有酪氨酸)残基上的O-糖蛋白了解较少,这类O-糖蛋白包含至少10个独立通路,利用不同的酶和碳水化合物底物。严重的糖基化基因功能缺失突变会导致先天性糖基化障碍(CDG),且常累及大脑——超过80%的CDG病例存在神经功能障碍,同时,糖基化异常在常见脑部疾病中的作用,从遗传关联和死后研究中都变得日益明显。
尽管一些研究涉及O-甘露糖(O-Man)聚糖和O-N-乙酰葡糖胺(O-GlcNAc)聚糖,但近期研究表明,大脑中70%至80%的O-聚糖是O-GalNAc或黏蛋白型聚糖,且有研究支持O-聚糖在哺乳动物大脑正常功能和发育中的重要性,如至少两种GALNTs基因与精神分裂症显著相关,GALNT2突变会导致伴有严重神经精神症状的CDG,Cosmc/T-合成酶水平变化在阿尔茨海默病中被报道等,但O-GalNAc聚糖在哺乳动物大脑中的功能和糖蛋白表达仍缺乏了解。为此,本研究通过特异性遗传阻断O-GalNAc糖基化合成途径(图1),以探究其在哺乳动物大脑中的空间定位、O-糖蛋白组及功能。
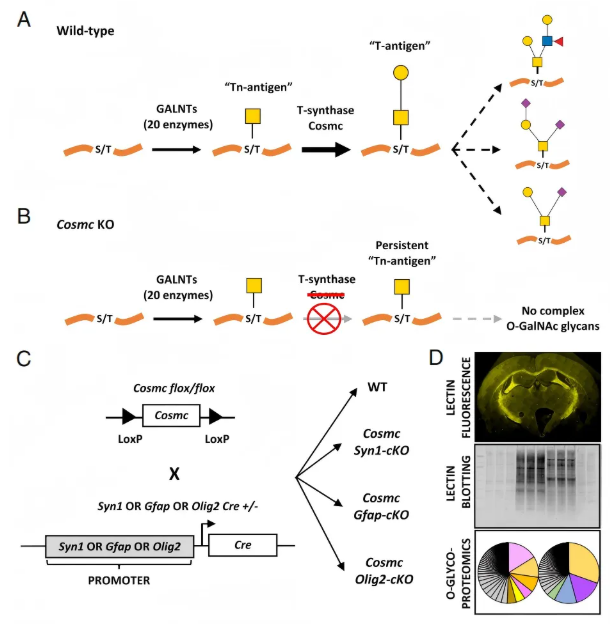
图1. 针对大脑中的黏蛋白型O-GalNAc糖基化
研究结果
1、复杂O-聚糖的合成能力及在神经束中的富集定位
复杂O-聚糖的生物合成酶(如Galnt家族成员、T-合成酶及其伴侣蛋白Cosmc)在所有脑细胞类型中均有转录本表达,表明各类细胞均具备合成所需的酶,相关分析基于小鼠皮层和小脑的单细胞表达数据。内源性O-聚糖在神经束中富集,通过花生凝集素(PNA,可识别O-聚糖的T抗原)观察发现,PNA 与唾液酸化的O-聚糖结合能力较弱(图2A);因小鼠大脑中超过90%的O-GalNAc聚糖存在唾液酸化修饰,故对比神经氨酸酶(NeuA)处理前后的PNA结合情况,可见野生型小鼠小脑髓质白质的神经束中基线PNA分布呈显著富集模式(图2B),经NeuA处理后PNA结合量增加且神经束中信号最强,联合O-糖苷酶处理则减少结合(图2B)。高倍放大显示髓质中PNA结合呈密集点状及弥漫信号(图2C);多个脑区冠状切片(图2D)显示神经束中PNA染色一致(图2E),如小脑髓质、脑干锥体束等区域,且经NeuA处理后结合增强(图2E)。不同脑区因神经束走向不同呈现特定模式:嗅球神经束与冠状切片垂直,PNA结合呈点状;胼胝体神经束与冠状切片平行,结合呈条纹状。此外,Jacalin凝集素的结合情况也支持O-聚糖在神经束中的富集。
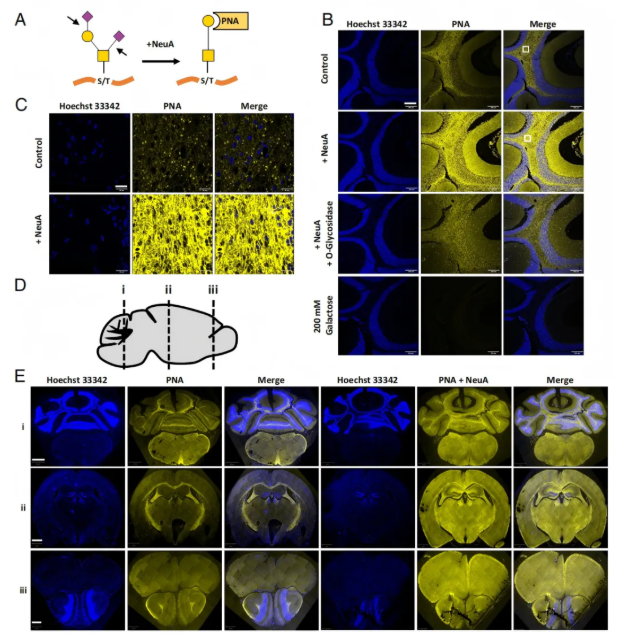
图2. 花生凝集素(PNA)结合在神经束中富集
2、脑内O-聚糖与N-聚糖的空间分布差异
O-聚糖在神经束中的意外富集,促使研究人员将其与N-聚糖的空间分布进行比较(图3A)。以结构分层明显的小脑为研究对象(其分子层ML、颗粒层GL、髓质AV结构如图3B所示),结果显示,针对特定N-聚糖的多种凝集素(如ConA、GNL等)主要结合于分子层,对颗粒层和髓质的结合水平不同(图3A);而识别O-聚糖的PNA信号独特,在包括髓质在内的神经束中富集。对小脑中多种凝集素信号强度的量化表明,仅PNA对髓质亲和力最高,凸显了两者在空间表达上的差异(图3C)。
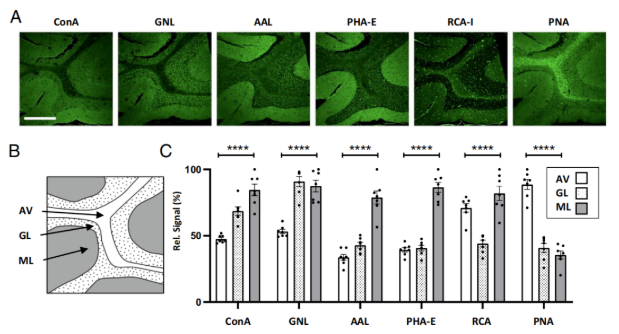
图3. O-GalNAc在神经束中的富集与N-聚糖不同
3、神经元和星形胶质细胞中Cosmc缺失对O-聚糖的影响及表型分析
通过将携带floxed位点的Cosmc雌性小鼠与Syn1-Cre⁺、Gfap-Cre⁺雄性小鼠杂交,构建了针对神经元(Cosmc Syn1-cKO)和星形胶质细胞(Cosmc Gfap-cKO)的条件性敲除小鼠(图1C)。两种敲除品系在成年早期前均未出现早期产后致死或明显行为/神经异常,表明抑制神经元和星形胶质细胞中延伸型O-聚糖表达未导致早期致死或明显病理改变。
生化检测显示,敲除型雄性小鼠脑裂解物中,野豌豆凝集素(VVA)结合信号显著(图4A-B),证实O-GalNAc聚糖延伸受抑且品系间模式不同;经神经氨酸酶(NeuA)处理后,PNA总结合量未显著减少(图4C),仅部分条带缺失;刀豆凝集素A(ConA)结合未变,表明N-聚糖合成不受影响(图4D);凝集素结合量归一化后多只小鼠定量结果一致(图4E)。
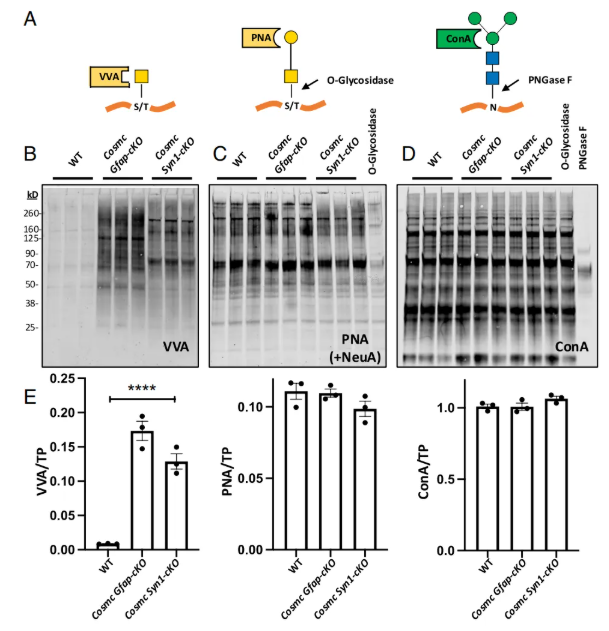
图4. 在Syn1和Gfap表达细胞中进行Cosmc基因敲除对总O-GalNAc水平影响极小
4、小脑中PNA与VVA分布在Cosmc条件性敲除品系中的反向相关性
尽管Cosmc Syn1-cKO和Gfap-cKO品系中总PNA水平未变,但PNA和VVA的染色及迁移模式差异显示,两种模型中O-GalNAc糖基化存在独特改变(图4B-C)。共染色结果表明敲除小鼠的大脑整体结构未受破坏。
野生型大脑中VVA阳性信号极低,Syn1-cKO品系中通过竞争性GalNAc验证了VVA染色特异性。Cosmc Syn1-cKO小鼠的VVA染色呈斑点状且在髓质神经束中富集,Cosmc Gfap-cKO小鼠的VVA染色呈弥漫性且髓质神经束中含量最低(图5A)。与野生型相比,Cosmc Syn1-cKO小鼠髓质中PNA染色减弱,Cosmc Gfap-cKO小鼠分子层中PNA染色减弱(图5B)。这些发现说明不同细胞群的O-聚糖合成有差异,且细胞特异性Cosmc缺失后,PNA与VVA结合呈空间反向相关。
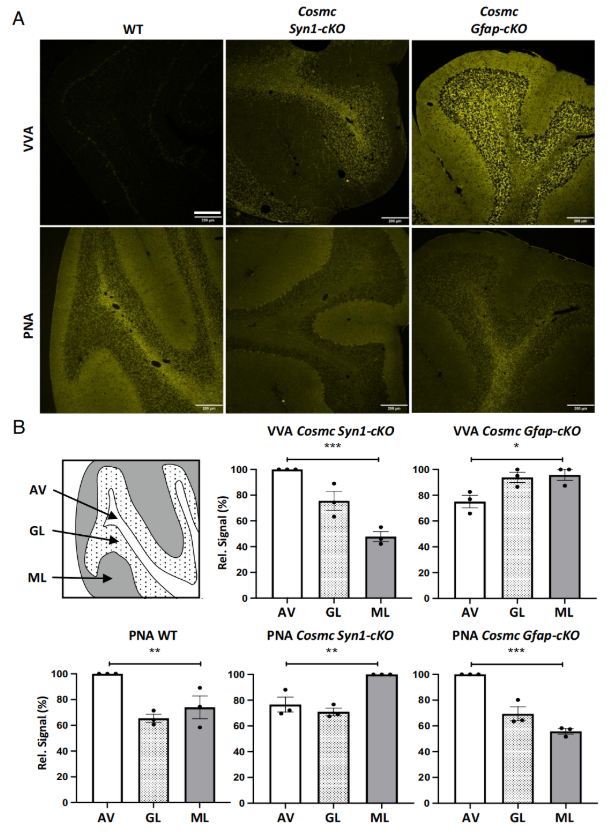
图5. 不同条件性敲除(cKO)品系中野豌豆凝集素(VVA)和花生凝集素(PNA)的结合分布存在差异
5、哺乳动物大脑中O-聚糖的载体鉴定及特性分析
为确定O-GalNAc载体,研究通过神经氨酸酶(NeuA)处理、花生凝集素(PNA)亲和纯化等步骤,结合液相色谱-质谱联用(LC-MS/MS)分析野生型脑组织,共检测到3528个O-糖肽、114种聚糖类型(其中H1N1A1和H1N1为主要类型)及143个对应基因(图6A-C)。
超过半数O-糖肽来自聚集蛋白聚糖家族的神经蛋白聚糖(Ncan)、短蛋白聚糖(Bcan)和多功能蛋白聚糖(Vcan),其O-聚糖主要位于中央非同源结构域,且不同肽段的O-聚糖类型存在差异(图6D-E)。经神经氨酸酶处理后,65%的O-聚糖缺乏唾液酸,但仍有充足PNA结合位点,岩藻糖基化O-聚糖丰度与既往研究接近。GO分析显示O-聚糖载体在突触及细胞黏附、发育等过程中富集。
对比本研究方法与IMPa蛋白酶法,两者结果互补,但本方法在糖肽、聚糖质量及糖蛋白载体的检测数量上更具优势,同时两种方法各有特异性检测的蛋白质(如IMPa可检测突触结合蛋白1等,而PNA富集法不能)。
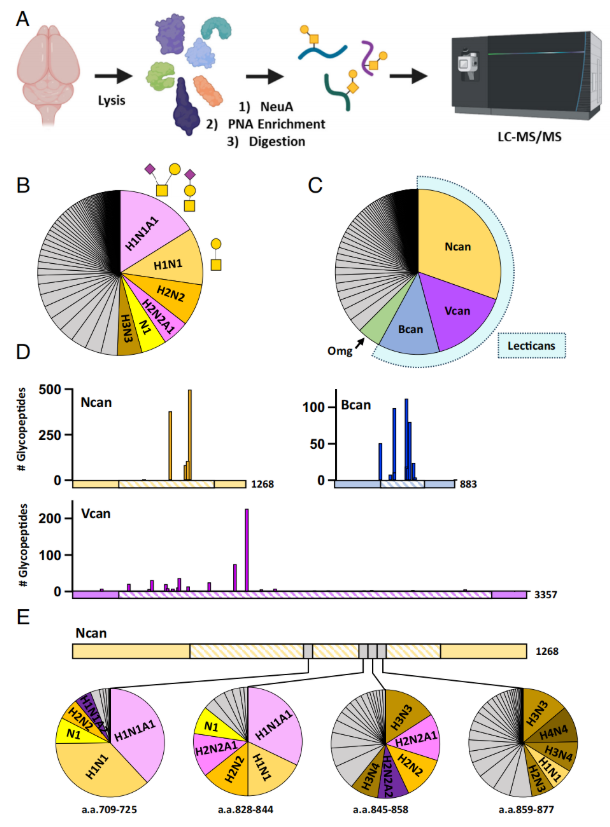
图6. O-GalNAc在聚集蛋白聚糖上富集,且不同糖肽间的聚糖质量存在差异
6、O-聚糖在郎飞氏结的分布及Cosmc缺失对其的影响
O-聚糖在郎飞氏结处大量存在,PNA的点状信号直接定位于郎飞氏结内(图7A)。Siglec-4(MAG)由少突胶质细胞表达,虽传统认为其结合神经节苷脂的唾液酸,但实验显示其与大脑中丰富的O-聚糖二唾液酸化T抗原结合能力最强,且重组MAG与小脑组织的结合区域和PNA重叠,均在神经束中富集并呈点状染色(图7B)。
神经元中Cosmc缺失(Cosmc Syn1-cKO)使郎飞氏结长度显著缩短20%,其他品系无变化(图7C);同时,该品系脑组织裂解物中重组MAG的结合信号降低,归一化后结合量减少约25%(图7D-E)。
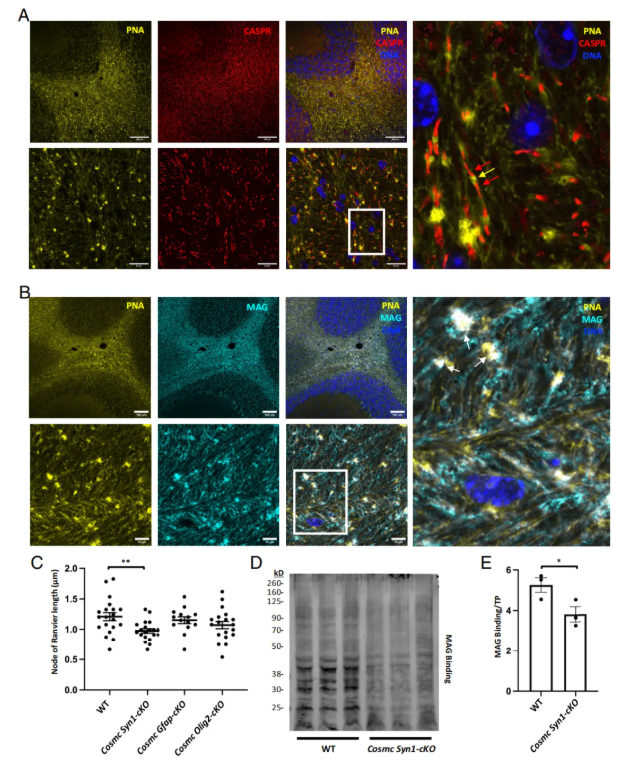
图7. O-GalNAc聚糖与郎飞氏结及Siglec-4(MAG)的结合共定位并对其发挥调控作用
研究小结
该研究聚焦哺乳动物大脑中O-GalNAc聚糖,绘制了其蛋白质载体的细胞特异性、空间分布及分子身份的全面图谱。研究发现,O-聚糖在神经束和郎飞氏结处富集,存在于聚集蛋白聚糖等多种关键脑发育相关蛋白质上(图8A)。在神经元中抑制O-聚糖合成(Cosmc Syn1条件性敲除),会导致郎飞氏结长度缩短、Siglec-4(MAG)结合减少(图8B)。这些结果揭示了O-聚糖在大脑中此前未被认识到的重要作用。
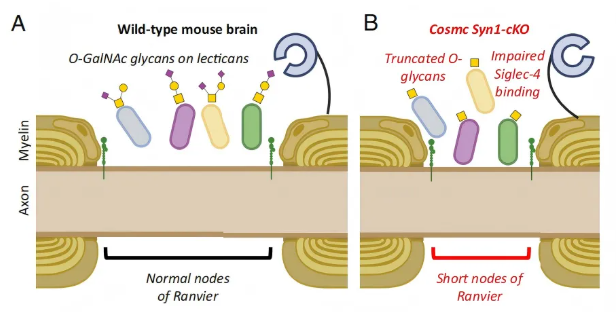
图8. 哺乳动物大脑中O-GalNAc聚糖的模型示意图
全景修饰蛋白质组学:作为一种蛋白质翻译后修饰(PTM)研究技术,仅需一份生物样本,即可实现对样本中的多种蛋白质修饰类型进行鉴定与定量分析,能够一次性精准鉴定数千种蛋白质上的上万个修饰位点,有效规避了传统方法因单次仅关注一种修饰类型而导致的大量关键修饰信息遗漏问题。百趣生物推出的全景修饰蛋白质组学技术,目前已实现对多种重要蛋白质翻译后修饰类型的覆盖,包括磷酸化、乙酰化、乳酸化、泛素化、琥珀酰化等。从生物学功能层面来看,这些翻译后修饰可通过改变蛋白质的理化性质、空间构象及活性状态,在细胞信号传导通路调控、物质代谢网络平衡、疾病发生发展的分子机制等核心生理病理过程中发挥不可替代的关键调控作用。










