

文章标题:A functional role of meningeal lymphatics in sex difference of stress susceptibility in mice
发表期刊:Nature Communications
影响因子:17.694
发表时间:2022年8月
作者单位:中山大学中山医学院
百趣提供服务:发现代谢组学Standard-亲脂版
研究背景
抑郁症(Major Depressive Disorder, MDD)作为一种常见的精神疾病,其特征是持续的抑郁情绪以及动力和兴趣的丧失。现如今,影响全球约4.4%的人口,是非致命健康损失的主要原因。目前研究表明,女性比男性更容易患上抑郁症,并伴随着更严重的抑郁症状。尽管在临床报告中已有充分的证据证明抑郁症存在着显著的性别差异,但其潜在的机制很大程度上仍不清楚。
重复应激是促进抑郁症发病的重要环境因素。有学者发现,反复的压力同时也会引起免疫系统的显著变化。尽管这些发现表明异常免疫功能与抑郁症之间有很强的联系,但对于压力如何改变免疫系统来调节抑郁症的易感性,我们仍然知之甚少。长期以来,中枢神经系统(Central Nervous System, CNS)一直被认为是一种“免疫特权”器官,因为它缺乏淋巴管来运输免疫细胞。然而,最近的研究证实了人类和其他动物的硬脑膜中存在淋巴管。这些脑膜淋巴管通过连接颈深淋巴结(deep Cervical Lymph Nodes, dCLNs)不断将CNS的液体和分子引流到外周,并在免疫细胞的主动运输中发挥重要作用。据报道,发生在衰老过程中脑膜淋巴管的改变,能够促使神经退行性和神经系统疾病的进展,包括阿尔茨海默氏病、帕金森病、创伤性脑损伤、脑炎和脑瘤。然而,应激是否影响脑膜淋巴调节抑郁症的发展仍有待进一步研究。
研究方法
在这项研究中,我们使用亚慢性变应激(Sub-Chronic Variable Stress,SCVS)刺激小鼠,在6d内将小鼠暴露于三种交替的应激源中。据报道,这种模式会诱导女性产生抑郁症状,但在男性中没有。因此模式为本研究内容提供了一个合适的模型。
实验前每天处理动物2~3min,连续处理3d。然后,它们在6d内交替受到三种不同的压力源,以避免习惯化:第1d,小鼠接受100个(0.45mA,1s)的随机间隔脚电击,持续1h。第2d,小鼠接受尾悬挂压力,持续1h。第3d,将每只小鼠置于家中笼子的穿孔约束管中,持续1h。在接下来的3d里重复同样的压力源(图1)。
图1. SCVS处理和行为测试的实验时间表
研究结果
1.亚慢性变应激对雌性小鼠脑膜淋巴细胞有损害作用,但对雄性小鼠无影响
在SCVS处理后,雌雄小鼠均有显著的体重减轻(图2b,3b)。另外,应激雌性小鼠较少前往开阔场地的中心区域(图2f-i),表现出抑郁和焦虑样行为。
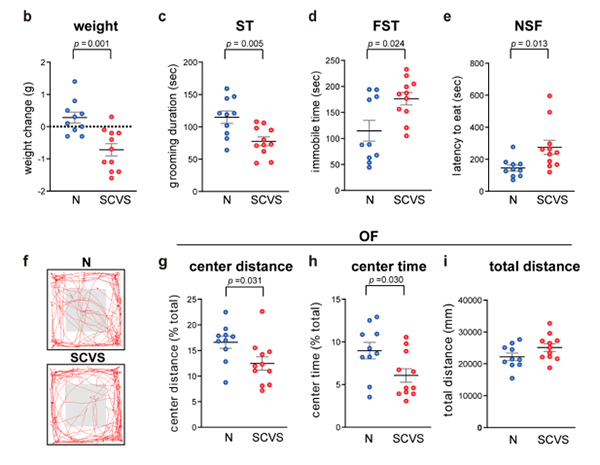
图2. 6d的SCVS诱导雌性小鼠的抑郁和焦虑样行为
相比之下,应激雄性小鼠在开阔视野中心区域的行走距离显著增加,显示出抗焦虑表型(图3f-i)。
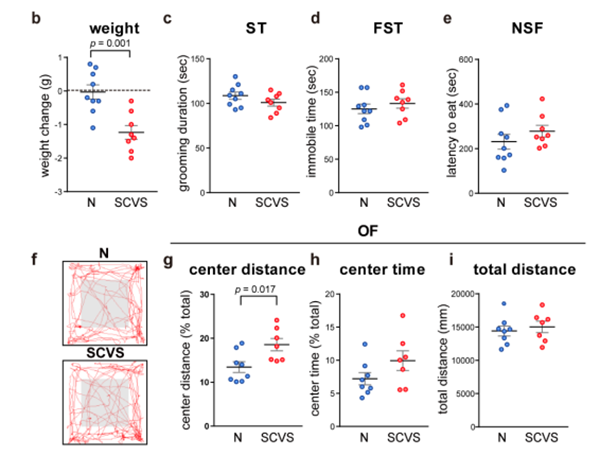
图3. 6d的SCVS诱导雄性小鼠的抑郁和焦虑样行为
qPCR分析显示,SCVS处理显著降低雌性小鼠硬脑膜淋巴管内皮受体-1(Lymphatic vessel endothelial Receptor-1, Lyve1)的mRNA水平,而SCVS处理下的雄性小鼠无显著降低(图4a-c)。
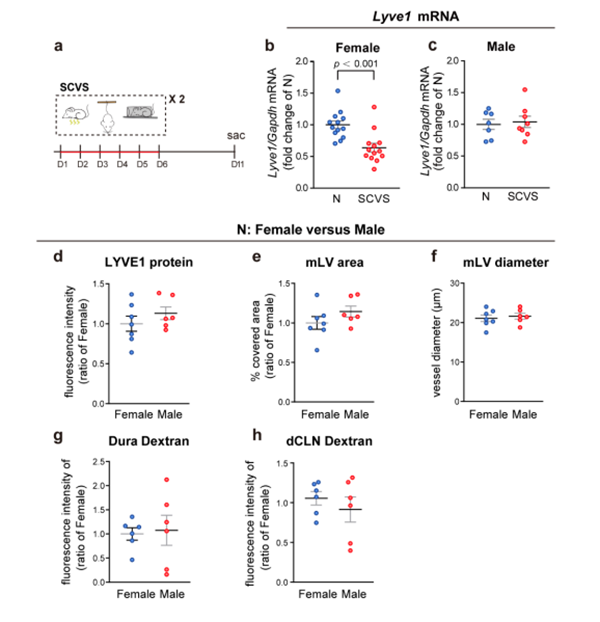
图4. SCVS引起的硬脑膜Lyve1 mRNA表达变化的性别差异,以及幼稚雌性和雄性小鼠脑膜淋巴管的比较
为了进一步验证SCVS处理对雌性小鼠脑膜淋巴的损伤,在最后一次行为测试72h后向小脑延髓池注入70kD葡聚糖示踪剂,1h后恢复正常(图5a-c)。
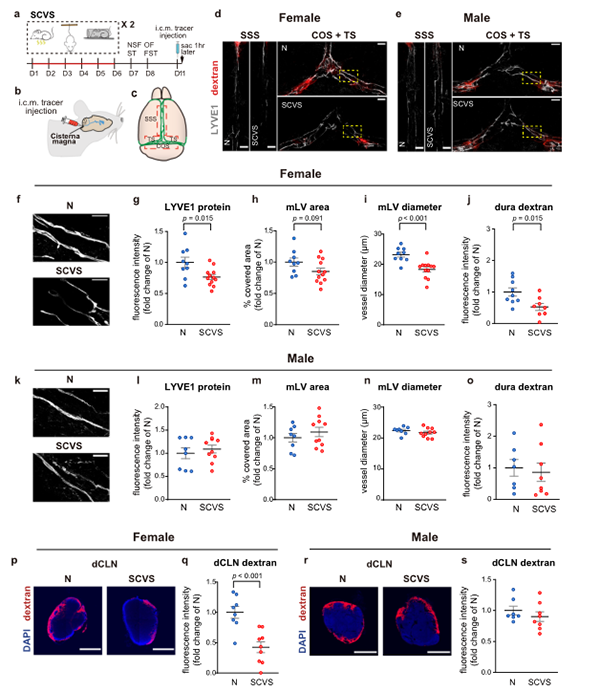
图5. SCVS损害雌性小鼠而非雄性小鼠的脑膜淋巴管
研究结果发现雌性小鼠出现脑膜淋巴管形态的损伤(图6)。相比之下,雄性小鼠在SCVS处理后,脑膜淋巴系统虽然对应激表现出一定的敏感性,但与非应激成年雌性和雄性小鼠相比,脑膜淋巴管的整体形态以及脑内注射示踪剂到dCLNs的引流没有显著差异(图4d-h)。
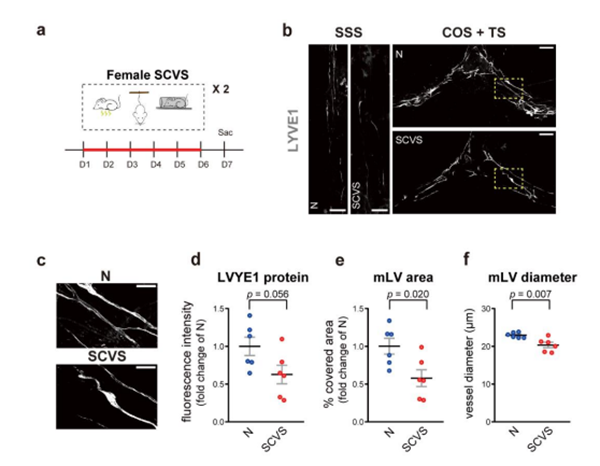
图6. SCVS处理过的24h后雌性小鼠的脑膜淋巴管受损情况
2.改善脑膜淋巴管可减轻雌性小鼠对应激的敏感性
为了研究改善脑膜淋巴系统能否使雌性小鼠抗应激能力增强。将血管内皮生长因子c(Vascular Endothelial Growth Factor-C, VEGFC)过表达的腺相关病毒(Adeno-Associated Virus, AAV)或增强型绿色荧光蛋白(enhanced Green Fluorescent Protein, eGFP)注射到雌性小鼠的小脑延髓池中作为对照。一个月后,两组小鼠均接受6d的SCVS处理(图7a)。结果显示VEGFC处理的雌性小鼠在SCVS处理后体重下降程度显著减少(图7k)。在溅水测试中,它们的梳理时间显著增加,在强迫游泳测试中减少了静止的时间,并增加了在开放场地测试中对中心区域的探索(图7l-p)。
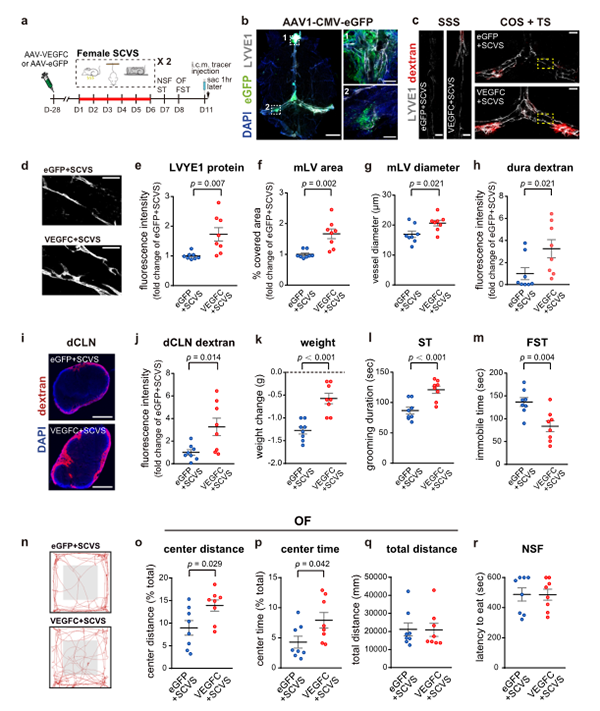
图7. 脑内注射AAV-VEGFC改善了雌性小鼠的脑膜淋巴管,减轻了应激诱导的抑郁样行为
在非应激雌性小鼠中,脑内注射AAV-VEGFC促进了脑膜淋巴生长,但不影响上述行为(图8a-m)。这表明脑膜淋巴管的增强本身并不足以改变雌性小鼠的抑郁或焦虑类行为,相反,增强了它们对压力的适应能力。
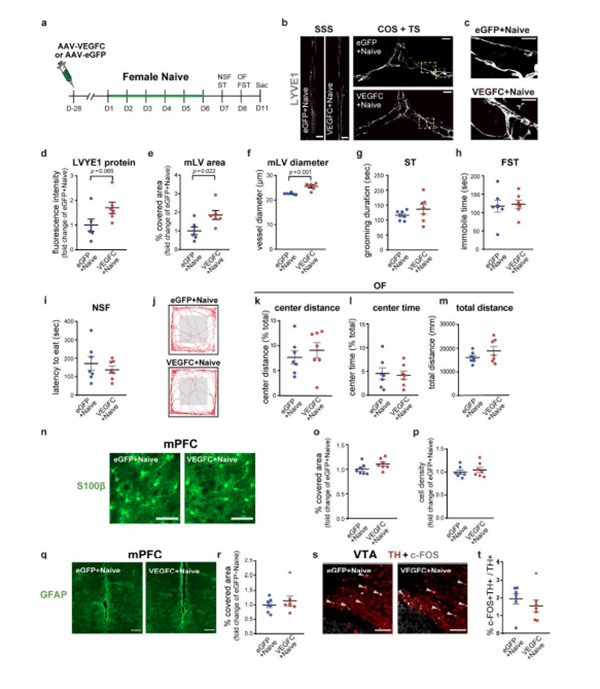
图8. AAV-VEGFC的池内递送改善了脑膜淋巴管,而不影响抑郁行为以及非应激雌性小鼠mPFC中星形胶质细胞蛋白的表达和VTA多巴胺能神经元中c-FOS的表达
另外,与非应激组相比,经历SCVS处理的雌性小鼠对社交活动和蔗糖水的偏好显著降低,而这两种偏好都被子宫内注射AAV-VEGFC所消除(图9a-e)。
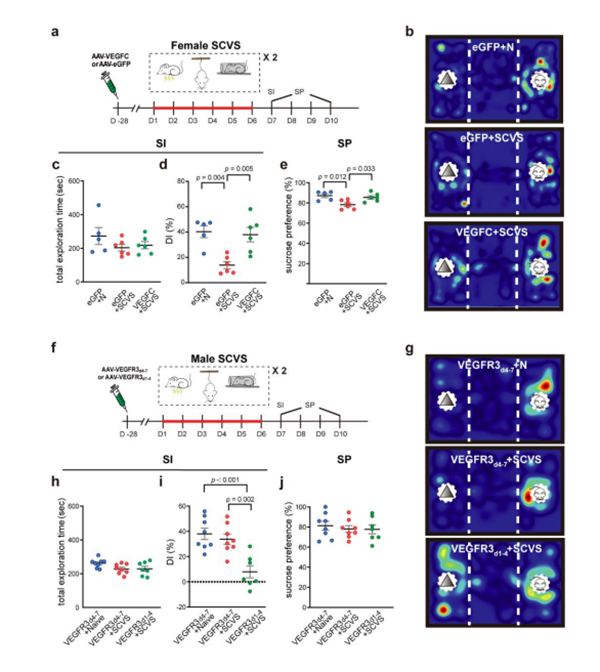
图9. 操纵脑膜淋巴管调节SCVS诱导的社交障碍和蔗糖偏好
3.脑膜淋巴管的改善可使应激引起的雌性小鼠的mPFC和VTA发生改变
为了观察SCVS和VEGFC处理是否会影响脑脊液在脑实质的流入和扩散,将卵白蛋白(OVA)-Alexa Fluor 647示踪剂注入雌鼠小脑延髓池,并于1h后灌流。SCVS处理减少了在脑实质、脑膜淋巴管附近和dcln中检测到的示踪剂(图2j,p,q和图10a-c),这表明SCVS处理增加了雌性小鼠脑室和蛛网膜下腔的示踪剂积累。
由于SCVS处理后间质流体(Interstitial Fluid, ISF)大分子的流动减少(图10l-q),我们推断SCVS处理损伤脑膜淋巴管可能导致脂质在脑实质积聚,进而导致内侧前额叶皮质(medial Prefrontal Cortex, mPFC)和中脑腹侧被盖区(Ventral Tegmental Area, VTA)异常,而VEGFC治疗阻止了这些变化。
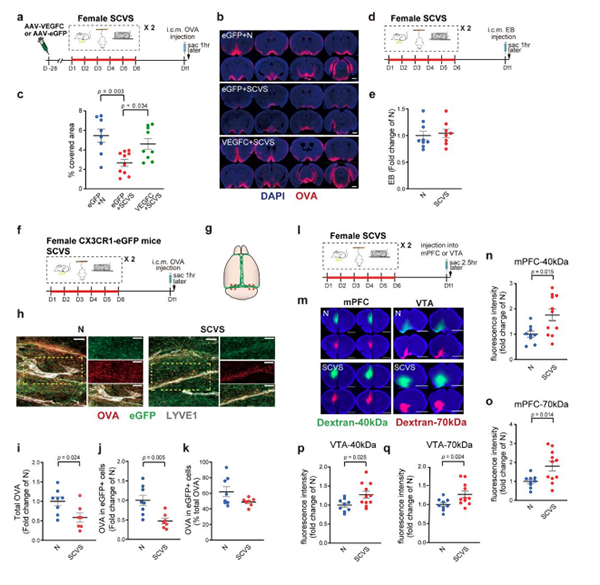
图10. SCVS后雌性小鼠脑内注射示踪剂的分布
为此,对mPFC、VTA和硬脑膜进行脂质组学分析,比较三组雌性小鼠:(1)未注射AAV-eGFP的小鼠;(2)注射AAV-eGFP并经历SCVS处理的小鼠;(3)小鼠注射AAV-VEGFC和经历SCVS处理(图11a)。通过OPLS-DA评分图发现三组分离明显(图11b)。SCVS处理后,包括长链甘油三酯(triacylglycerols, TAG)在内的多种脂质在mPFC中显著增加,而在SCVS处理后VTA中也有一小部分TAG的增加,这被VEGFC治疗部分阻止了(图11c,d)。重要的是,VEGFC治疗显著增加了硬脑膜中包括长链TAG在内的一组脂质分子(图11e)。
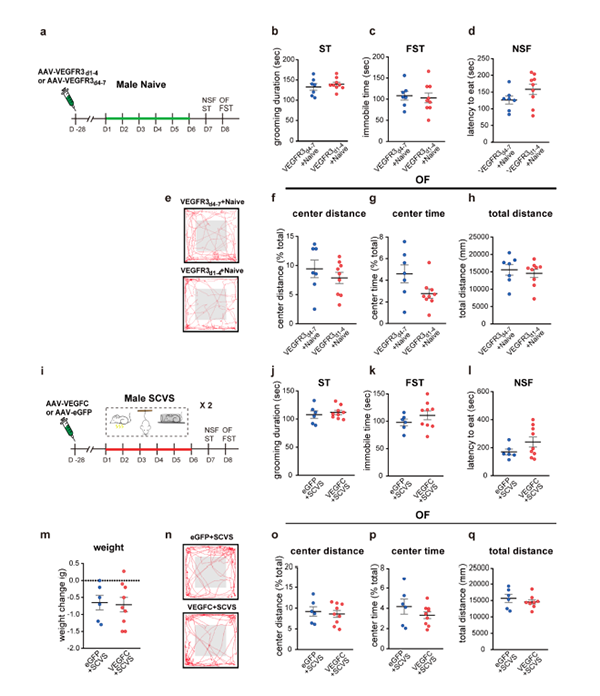
图11. 幼稚雄性小鼠脑内注射AAV-VEGFR3d1-4或经历SCVS的雄性小鼠AAV-VEGFC不会改变抑郁和焦虑样行为
4.脑膜淋巴管损伤使雄性小鼠易受应激影响
VEGFR3d1-4-IgG Fc的过表达显著降低硬脑膜上矢状窦(Superior Sagittal Sinus, SSS)和横窦(Transverse Sinus, TS)/窦汇(Confluence Of Sinuses, COS)中的Lyve1的表达,以及Lyve1标记的脑膜淋巴管的直径和覆盖面积(图12c-g)。同时,在硬脑膜和dcln中检测到的腔内注射示踪剂的数量显著减少(图12c,h-j)。
重要的是,VEGFR3d1-4-IgG Fc过表达的雄性小鼠在溅水试验中梳洗时间显著减少,在强迫游泳试验中静止时间显著增加,并在SCVS处理后表现出社交障碍(图12k,l和图9f-I)。VEGFR3d1-4或vegfr3d4-7过表达的雄性小鼠在抑制摄食试验中,在进食潜伏期、体重变化、整体运动和开放场地试验中对中心区域的探索方面均无显著差异,在蔗糖偏好试验中也无显著差异(图12r和图9f,j)。
值得注意的是,在没有SCVS处理的情况下,VEGFR3d1-4单独治疗并不会影响非应激雄性小鼠在抑郁行为测试中的表现(图11a-d),这表明脑膜淋巴损伤本身不足以诱导雄性小鼠的抑郁行为,但会增加它们对应激的敏感性。此外,SCVS处理的雄性小鼠中,脑内注射过表达VEGFC的AAV并不会影响动物在抑郁和焦虑类行为测试中的表现,也不会影响体重的变化(图11i-q),这表明脑膜淋巴在调节抑郁和焦虑类行为中的作用存在“天花板效应”。
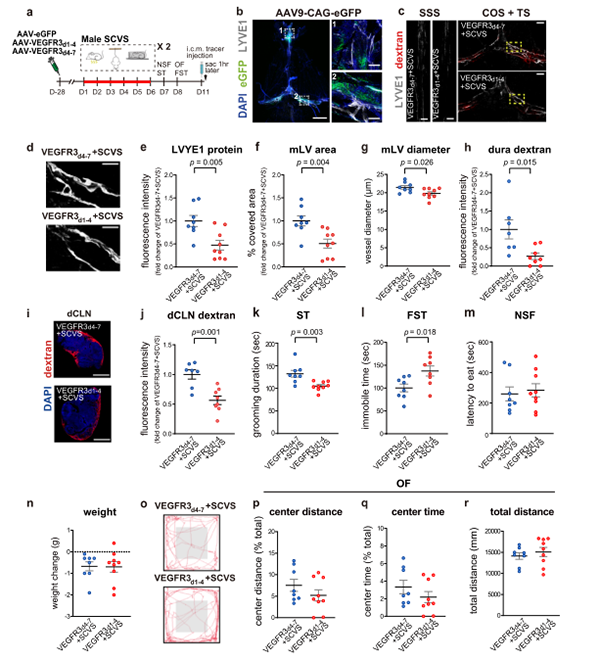
图12. 脑内注射AAV-VEGFR3d1-4可损害雄性小鼠脑膜淋巴管痉挛并促进应激诱导的抑郁行为
另外,SCVS处理并未显著改变雄性小鼠mPFC中星形细胞蛋白的表达,也未改变VTA中TH+多巴胺能神经元中c-FOS的表达。然而,VEGFR3d1-4处理后的雄性小鼠在mPFC中S100β+和GFAP表达明显减少,S100β+星形胶质细胞密度降低,在VTA中TH+多巴胺能神经元中c-FOS表达减少(图13-j)。
综上所述,脑膜淋巴管的损伤或通过脑膜淋巴管的引流增加了雄性小鼠对应激的敏感性,并促进了应激引起的mPFC和VTA的异常。
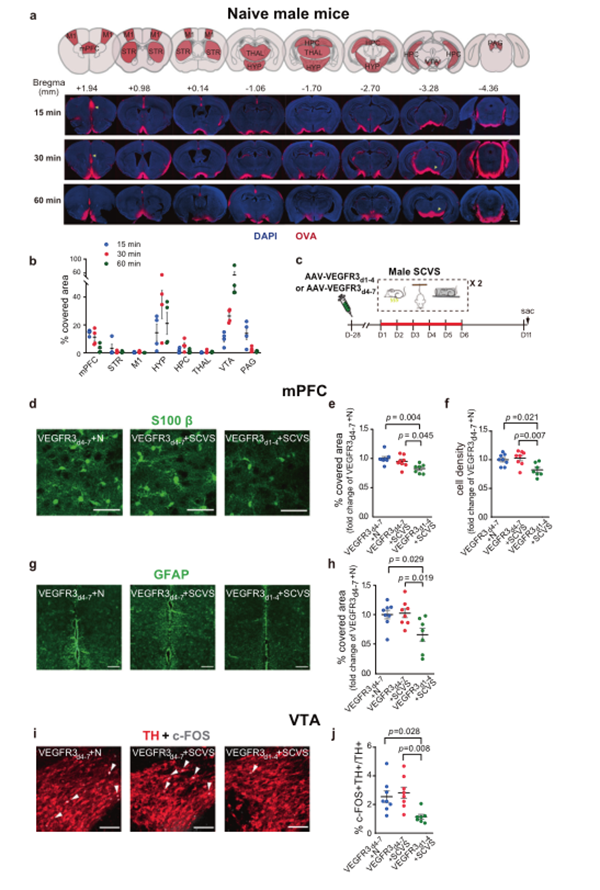
图13. 雄性小鼠脑内注射AAV-VEGFR3d1-4可促进SCVS诱导的mPFC星形胶质细胞标志物表达受损和VTA多巴胺神经元c-FOS表达受损
5.亚慢性可变应激改变雌性小鼠脑膜淋巴内皮细胞的转录谱
与非应激小鼠相比,应激雌性小鼠的硬脑膜中晶状体上皮细胞(Lens Epithelial Cells, LECs)占存活细胞总数的百分比显著降低。进一步证明SCVS损害脑膜淋巴系统(图14c)。其他脑膜细胞类型未检测到明显变化,包括血液内皮细胞、白细胞和基质细胞 (图14d-f)。
Deseq2分析(一种转录组分析方法)以(p<0.1)为临界值,筛选出236个差异表达基因(DEGs),其中156个上调,80个下调(图14g,h)。值得注意的是,表皮生长因子受体的表达是受应激影响下调最多的基因之一,表明支持淋巴萌发的信号缺失(图14h)。我们进一步进行了基因集富集分析,结果显示,在应激雌性小鼠的脑膜LECs中,参与DNA复制、鞘脂生物合成、血清素摄取调控的基因集富集,而未在参与蛋白酶体组装、核糖体分解、血小板衍生生长因子结合的基因集富集,表明应激诱导的脑膜淋巴管功能发生了深刻变化(图14i)。另外,还发现几个编码胶原蛋白的基因,包括Col6a1,Col1a2,ndCol3a1以及编码处理胶原蛋白的基质金属蛋白酶Mmp23的基因,在应激和衰老中显著下调,这表明与细胞外基质的分离可能是介导脑膜淋巴变性的关键因素(图14k)。
数据显示CCL6基因的上调是雌性小鼠受到SCVS处理诱导的脑膜淋巴管覆盖减少的潜在机制。从RNA-seq结果来看,C-C基序趋化因子受体(Ccr1,CCL6的受体)在未接种组雌性小鼠的脑膜LECs中表达较低。在SCVS处理组的5个生物重复中,有2个Ccr1mRNA水平升高,但在其他3个重复中保持较低水平。基于这些数据,我们怀疑CCL6可能以细胞非自主的方式起作用,通过向硬脑膜细胞中介体发出信号,进而导致SCVS处理后雌性小鼠脑膜淋巴覆盖的减少。
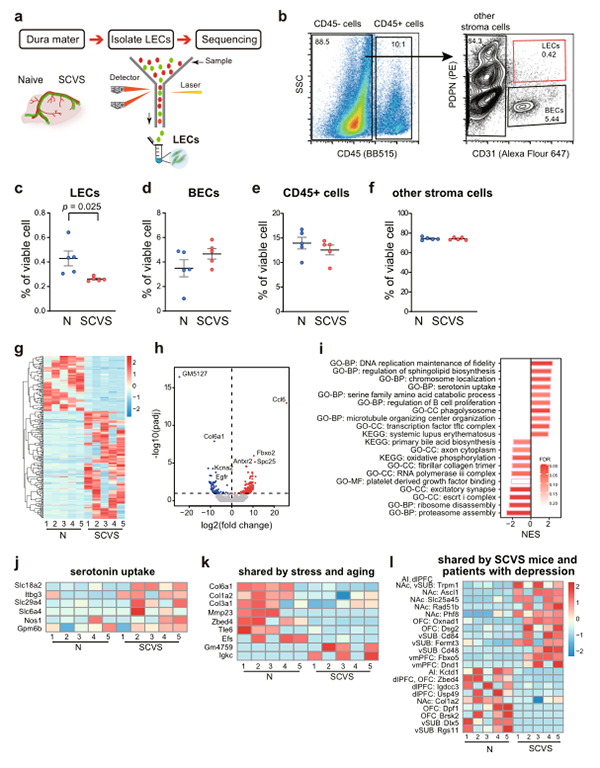
图14. SCVS诱导雌性小鼠脑膜淋巴管内皮细胞转录变化
结论
研究发现SCVS处理对雌性小鼠脑膜淋巴细胞有损害作用,而对雄性小鼠无损害作用。功能获得与丧失的研究进一步表明,脑膜淋巴管导致了小鼠对抑郁和焦虑行为应激敏感性的性别差异。结果揭示了短期应激对脑膜淋巴管形态和通过脑膜淋巴管的脑引流功能具有性别依赖性。另外,脑膜淋巴管的变化可以调节应激敏感性。
文献下载链接:
https://pan.baidu.com/s/1rUH9mNV9RXbBdneg8i8eCQ
提取码:0000









