

英文标题:SCFA biotherapy delays diabetes in humanized gnotobiotic mice by remodeling mucosal homeostasis and metabolome
中文标题:短链脂肪酸生物疗法通过重塑黏膜稳态和代谢组,延缓人源化无菌小鼠的糖尿病发作
发表期刊:nature communications
影响因子:15.7
研究背景
1型糖尿病(Type 1 diabetes, T1D)属于自身免疫性疾病,由T细胞介导免疫攻击,致使胰腺胰岛中分泌胰岛素的β细胞遭受破坏,进而引发胰岛素绝对缺乏,血糖异常升高。这是一种代谢性病症,与因已知病因致使β细胞破坏所引发的糖尿病类型不同。T1D常见于青少年时期,典型症状为“三多一少”,即多饮、多食、多尿以及体重减轻。在病情严重或身体处于应激状态时,还可能引发糖尿病酮症酸中毒(DKA)、高渗高血糖综合征等急性严重代谢紊乱。
近年来,大量研究显示,肠道微生物群失调与T1D发病紧密相关。在T1D发病前,患者肠道微生物群组成往往已发生改变,例如拟杆菌属增多、厚壁菌门减少、β多样性降低等。其中一个显著的功能缺陷是肠道微生物产生短链脂肪酸(short-chain fatty acid, SCFA)的能力下降。SCFA减少与小鼠、新诊断儿童以及长期T1D成年患者的胰岛自身免疫反应存在关联。
SCFA作为肠道微生物群的重要代谢产物,具备诸多益处。它是肠道上皮细胞的关键能量来源,能有效调节免疫反应,还可提升胰岛β细胞在应激状态下的存活能力。比如,丁酸盐作为结肠上皮细胞的主要能量物质,能够促进调节性T细胞分化,抑制炎症细胞因子的产生;acetate则可调节B细胞活化以及IgA生成。鉴于此,通过特定手段恢复SCFA的产生水平,被视作一种颇具潜力的干预策略,有望延缓甚至阻止T1D的病情进展。
本研究聚焦于成年T1D患者,旨在深入探究SCFA生物疗法对肠道屏障功能、黏膜免疫以及代谢物产生的影响。为此,研究人员收集了这些患者在基线、6周(干预结束)和12周(随访)三个时间点的粪便及血浆样本,每个时间点各获取18份样本 。研究借助代谢组学、蛋白质组学、16S rRNA测序以及转录组技术平台,对样本展开全面分析。同时,将人类粪便微生物群移植到无菌NOD(非肥胖型糖尿病,nonobese diabetic)小鼠体内开展验证实验。本研究成果为评估SCFA生物疗法能否通过调控肠道微生物群来延T1D发病进程,提供了关键的理论支撑。
研究结果
1、SCFA生物疗法后人类粪便蛋白质组重塑
对先前已进行HAMSAB(一种经修饰可释放乙酸盐和丁酸盐的多糖生物分子)单臂实验的成年T1D患者粪便样本进行非靶标蛋白质组分析,共鉴定出738种蛋白。发现宿主粪便蛋白质组在基线、6周和12周三个时间点均有独特性,且干预停止后随访时间点的宿主粪便蛋白质组未恢复到基线水平(图1A-D)。在6周时,GO富集分析发现201个富集的生物学过程,包括细胞氧化还原稳态(抗氧化蛋白PRDX6、TXN和TXNRD1等增加)、缺氧反应、肌动蛋白丝通路、上皮细胞分化及中性粒细胞和髓细胞相关先天免疫过程,且随访时这些通路仍有持续影响(图1E)。KEGG通路富集分析发现,6周时19条通路显著富集,包括先天免疫通路、紧密连接通路、以及丙氨酸、天冬氨酸、谷氨酸代谢和精氨酸生物合成等代谢通路,其中关键蛋白如ASS1、CAD等增加。同时,SCFA生物疗法后,铁死亡和坏死性凋亡等细胞死亡通路相关蛋白减少(图1F-G)。
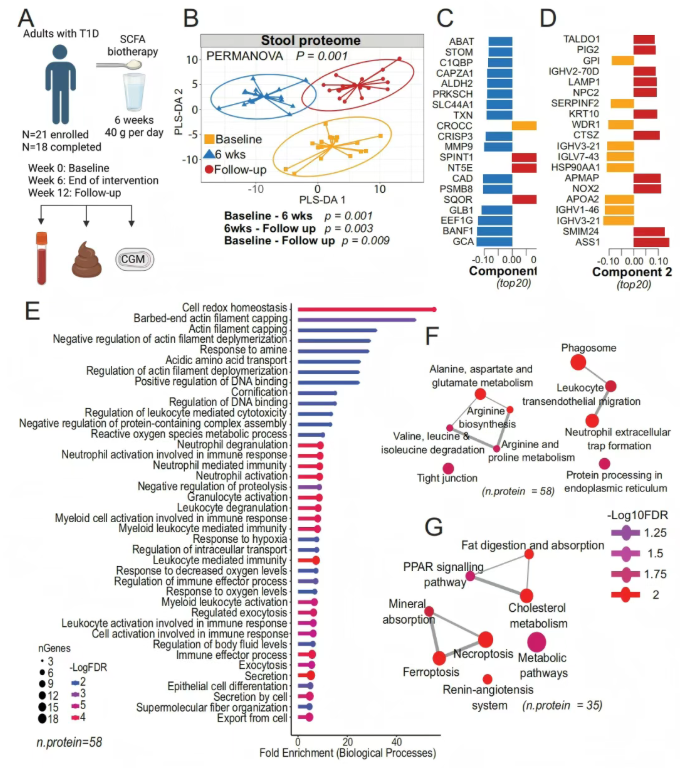
图1. SCFA生物疗法后的粪便蛋白质组学揭示肠道屏障蛋白重塑
2、SCFA生物疗法后肠道代谢物产生显著改变
通过非靶标代谢组学分析,检测到603种代谢物。6周时粪便代谢组与其他时间点明显不同,有101种代谢物在不同时间点存在差异,其中8种FDR<0.05(图2A-B);丙氨酸、天冬氨酸和谷氨酸代谢、丁酸代谢和精氨酸生物合成等通路在6周和随访时均显著富集(图2C-D)。粪便代谢物、通路和粪便蛋白质的综合分析支持SCFA生物疗法驱动TCA循环和丙氨酸、天冬氨酸及谷氨酸代谢的假设,导致谷氨酸和谷氨酰胺转化为嘌呤和嘧啶核苷酸,同时驱动尿素循环和精氨酸代谢(图2F)。从基线到第6周的变化主要与精氨酸生物合成的前体代谢物相关,而从基线到随访的变化则与精氨酸利用相关的代谢物变化有关(图2F)。
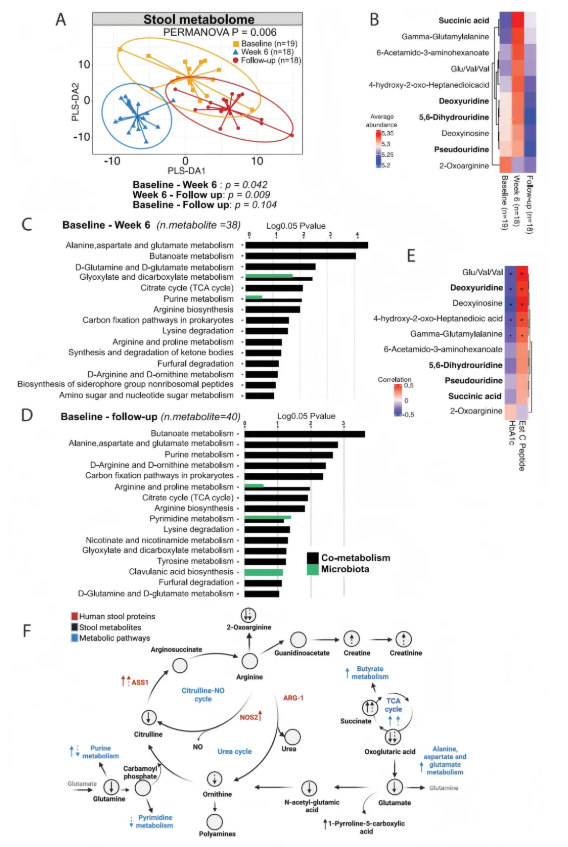
图2. SCFA生物治疗后肠道代谢产物产生发生显著变化
3、血浆代谢组学揭示SCFA生物治疗后的全身代谢效应
对血浆进行非靶代谢分析,鉴定出619种代谢物,随访组与其他两组间的血浆代谢物差异最大(图3A)。图3B显示假尿苷、异谷氨酰胺、犬尿氨酸、色氨酸等为PLS-DA第1主成分的主要载荷代谢物,反映各组间差异。富集分析发现,12周时色氨酸代谢以及苯丙氨酸、酪氨酸和色氨酸生物合成是受影响最大的通路(图3C),这归因于色氨酸、犬尿氨酸和吲哚丙酮酸的变化;此外,缬氨酸、亮氨酸和异亮氨酸的生物合成和降解通路也被富集。这些数据表明,SCFA生物疗法对代谢通路有持续的影响。
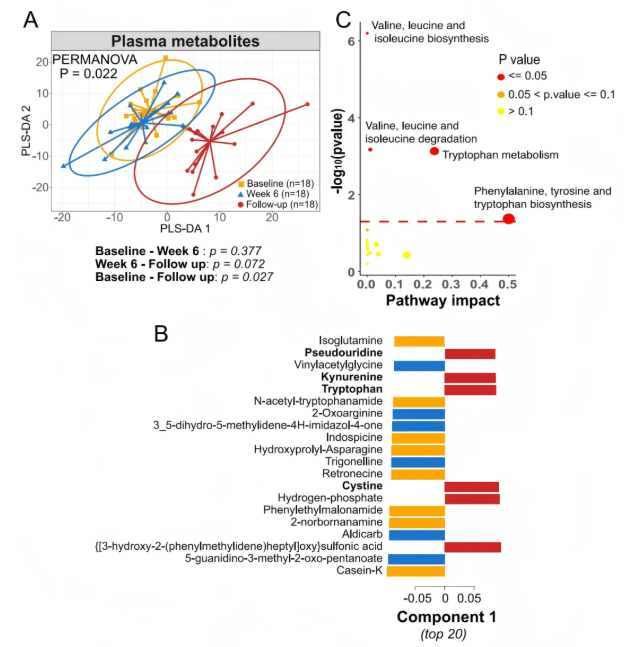
图3. 随访时血浆代谢物发生显著变化
4、微生物群移植模型证明了SCFA生物疗法修饰的微生物群对疾病的改善作用
基于粪便微生物群移植模型,进一步研究经SCFA生物疗法后人类微生物群的功能变化是否能够改变疾病进展(图4A)。鉴于HAMSAB显著增加了小鼠和人类粪便及循环中乙酸盐、丁酸盐和丙酸盐的浓度,研究者根据6周时粪便SCFA的增加倍数对参与者进行分类,增加倍数≥2的称为“应答者”,<2的称为“非应答者”(图4B)。将人类供体粪便样本的重悬液经口灌胃给雌性无菌NOD小鼠,于交配前实施该操作,然后对雌性后代的微生物群定植情况、代谢物水平和糖尿病进展进行研究(图4A)。一组对照母鼠灌胃无菌生理盐水(PBS),其后代保持无菌状态。
在整个实验过程中,与非应答者定植小鼠相比,应答者6周供体样本定植的小鼠后代粪便中的丁酸盐是唯一显著升高的SCFA,并且比两组用基线供体样本定植的小鼠都高(图4C)。与同一时间点的非应答者组和无菌组相比,用应答者6周时SCFA生物疗法后的微生物群定植的小鼠,糖尿病进展明显延迟(图4D)。相比之下,用应答者或非应答者基线样本定植的小鼠,与PBS对照组相比,未能显著延迟糖尿病的发生(图4E)。10周龄时,组织学和免疫荧光染色显示,与非应答者定植小鼠相比,应答者定植小鼠胰岛中的单核细胞浸润和胰岛素含量有减少的趋势(图4F)。这些数据表明,人类SCFA干预引起的微生物变化在过继转移后仍会影响小鼠自身免疫的发展,其保护作用主要与丁酸盐反应有关。
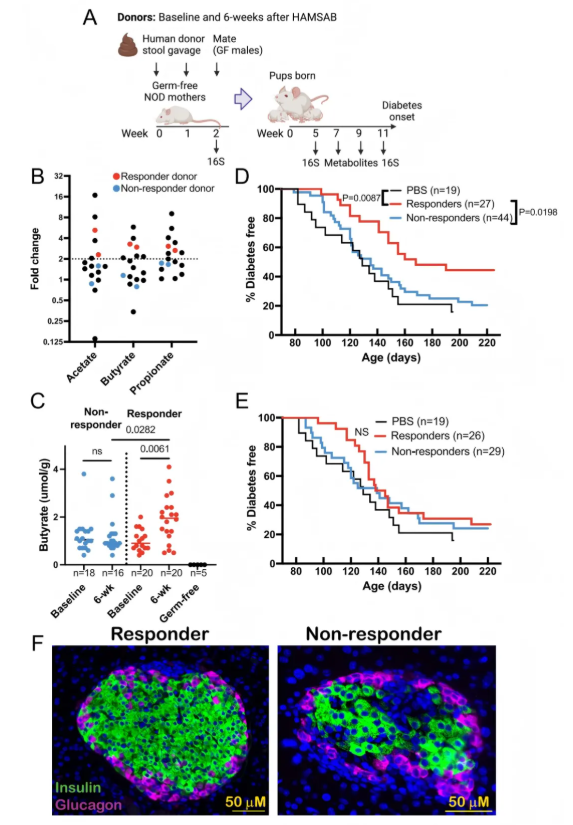
图4. 将应答者的人类微生物群移植到小鼠体内可延缓NOD小鼠糖尿病的发病进程
5、受保护的应答者定植小鼠通过粪便代谢物而非微生物群组成聚类
PCA分析表明,来自四个供体(2名应答者、2名非应答者)的定植小鼠的微生物群组成存在显著差异,其中供体D(非应答者)的微生物群组成与其他三组(供体A、B为应答者,供体C为非应答者)的距离更远,差异更显著(图5A)。接下来,对6周样本定植组后代的粪便代谢组进行分析,与微生物群组成的分散分布不同,PCA分析显示两个应答者供体(A、B)的后代代谢物谱在主成分空间中聚为一簇,而非应答者供体(C、D)的后代代谢物谱则分布在其外侧,呈现明显区分(图5B)。通路富集分析发现,与非应答者组相比,应答者组中嘌呤代谢、嘧啶代谢、精氨酸代谢及谷氨酸代谢通路的富集程度最高(图5C)。这些应答者组中变化的代谢物及富集通路,与人类试验参与者接受SCFA生物疗法后粪便代谢组的富集通路(如丙氨酸-天冬氨酸-谷氨酸代谢、精氨酸生物合成等)高度相似。综合分析表明,受糖尿病保护的应答者定植小鼠是按粪便代谢物聚类,而非微生物群组成。这意味着在SCFA生物疗法影响下,粪便代谢物在区分应答者和非应答者定植小鼠方面比微生物群组成发挥了更关键的作用,且这些代谢物变化与糖尿病保护可能存在密切联系。
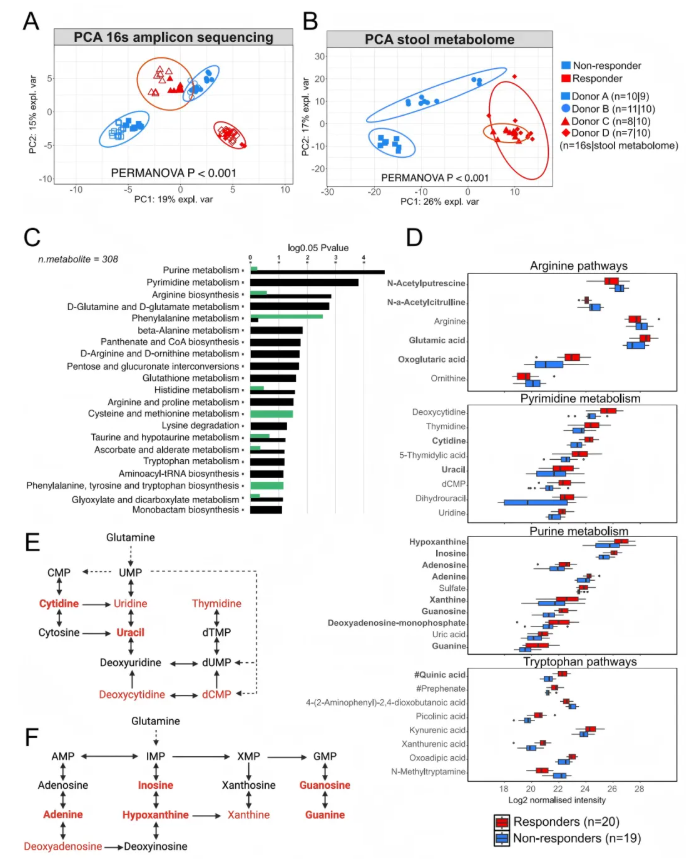
图5. 在人源微生物群移植到小鼠的研究中,驱动受体小鼠聚类的是粪便代谢物,而非肠道微生物群组成
6、应答者定植小鼠黏膜B细胞基因网络减少
通过转录组学研究发现回肠中有143个差异表达基因,结肠中有16个(图6A)。GO分析发现,非应答者回肠组织中多个与B细胞激活和免疫球蛋白产生、先天免疫反应、炎症反应、对细菌的防御反应以及对脂多糖的反应相关的通路被富集(图6B)。非应答者中B细胞通路的富集包括Ighg1、Ighg3和Ighd抗体重链基因,但不包括IgA重链基因,表明应答者和非应答者小鼠分泌的抗体类型存在差异。KEGG富集分析确定了应答者小鼠中几个参与色氨酸代谢的下调基因,包括Cyp1a1、Kmo和HAAO(图6C)。同时,NFκB信号通路、细胞因子受体相互作用以及B细胞受体信号通路在应答者小鼠中也下调。这一系列变化表明,定植应答者微生物群可降低小鼠的炎症性黏膜免疫,尤其是抗体产生。
为了进一步研究小鼠中免疫细胞的激活状态,研究者分析了一组10周龄后代的抗原呈递细胞表型。与基因表达数据一致,研究者发现用非应答者6周样本微生物群定植的小鼠中,IgM+B细胞上的CD40表达更高。与此平行的是,非应答者定植小鼠中总常规树突状细胞和2型树突状细胞的CD40表达也更高。这表明在非应答者定植小鼠中,类别转换的IgM+B细胞和树突状细胞的激活程度更高。
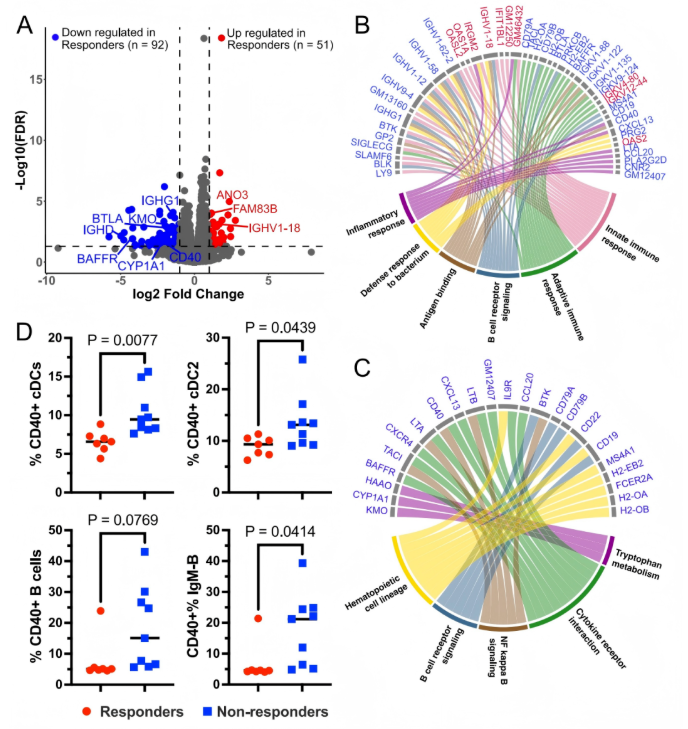
图6. 应答者微生物群定植小鼠回肠中B细胞、先天免疫及色氨酸代谢相关基因特征的变化
7、应答者定植小鼠芳烃受体配体生成增加
由于色氨酸代谢为生成芳香烃受体(Ahr)配体是肠道微生物群调节肠道稳态的关键机制,研究者研究了应答定植小鼠中Ahr配体的活性。图7A显示,应答者小鼠的粪便Ahr刺激活性高于非应答者小鼠。两组第6周样本定植小鼠的Ahr刺激活性均增加。随后,研究者使用人类研究参与者的粪便水提取物,证实干预后第6周Ahr配体活性显著增加(图7B)。通过免疫荧光染色,发现应答者小鼠回肠组织中Ahr和IgA蛋白表达均高于非应答者小鼠(图7C)。这表明SCFA生物疗法后Ahr配体可用性增加与糖尿病保护相关。
为鉴定可能导致Ahr活性差异的特定代谢物,通过“in silico”分析重新检索了代谢组数据集中的关键色氨酸通路代谢物。该分析发现黄尿酸在定植6周应答者供体微生物群的小鼠中含量显著更高。在人类粪便代谢组和血清中,黄尿酸等色氨酸代谢物也呈现出特定的变化趋势,这表明黄尿酸可能是小鼠和人类研究中激活Ahr的关键代谢物。
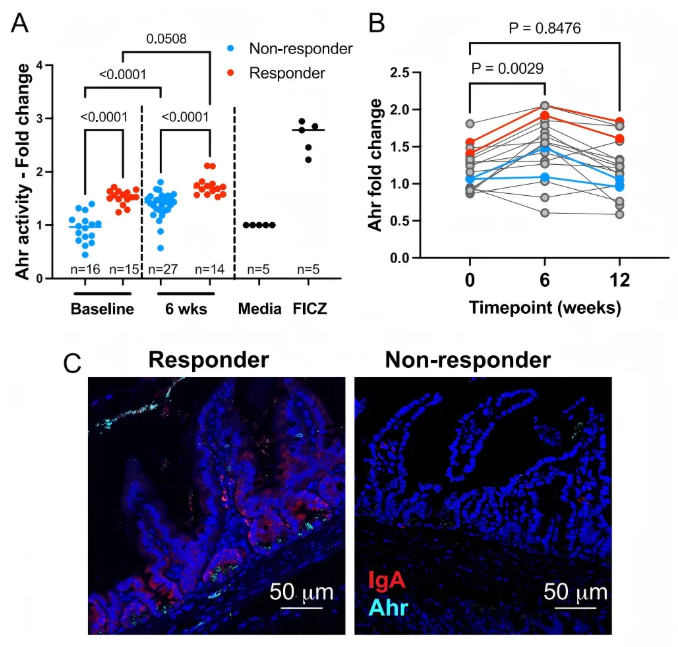
图7. 应答菌群定植小鼠中芳香烃受体活性增强
8、多组学关联分析
研究者使用多组学因子分析(Multi-Omic Factor Analysis, MOFA)探讨人类研究中不同组学、临床指标、SCFA和Ahr之间的关系。从模型中的不同数据集选择相关变量,识别解释数据潜在变异的潜在因子,将这些潜在因子与血糖控制指标、SCFA和Ahr活性相关联。识别出6个潜在因子,潜在因子3与粪便SCFA和估算的C肽正相关,正向变量主要为血浆色氨酸代谢物,负向变量包括生物疗法后减少的粪便代谢物。潜在因子4与粪便和血浆丁酸盐、Ahr活性正相关,与HbA1c和基础胰岛素负相关,由特定微生物和代谢途径驱动。潜在因子1与粪便Ahr活性、血浆乙酸盐负相关,受部分分类群和宏基因组途径影响。潜在因子2也与Ahr活性、HbA1c和基础胰岛素负相关,同样受特定分类群影响。综合分析显示,SCFA、血浆色氨酸代谢物以及粪便Ahr活性均和1型糖尿病患者血糖控制的临床特征存在相关性,为深入理解疾病机制和治疗靶点提供了依据。
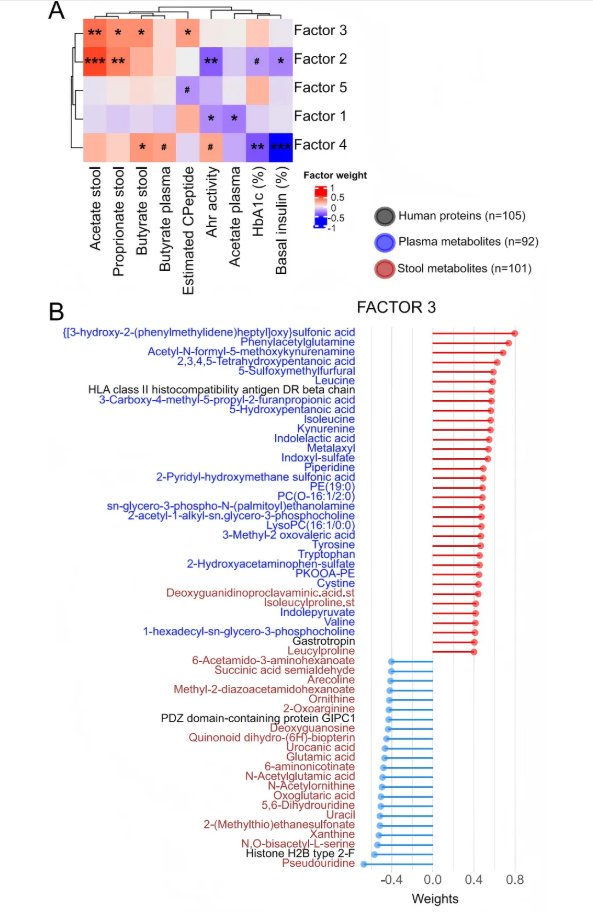
图8. 多组学因素分析(MOFA)确定了与血糖控制、SCFA和Ahr活性相关的潜在因素
研究结论
这项研究首次证明SCFA生物疗法可重塑T1D患者的黏膜免疫和肠道屏障反应,SCFA生物疗法通过激活精氨酸代谢、调节色氨酸代谢等多种代谢途径,增强了肠道屏障功能,调节了免疫反应,从而延缓了糖尿病进展。这些发现为T1D的治疗提供了新的思路和潜在靶点,表明通过调节肠道微生物群和代谢途径,有望开发出有效的T1D治疗策略。
新一代代谢组学NGM 2 Pro:凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。
蛋白冠-DIA:采用数据非依赖采集(DIA)模式对每例实验样本进行检测。该模式在预设扫描窗口内实现所有母离子的二级碎裂,具有高重现性优势,可获取更丰富的谱图信息,从而提升定性定量结果的覆盖度与可靠性。百趣推出的蛋白冠-DIA蛋白质组学解决方案,采用磁珠法进行样本前处理,并整合自动化前处理设备。此方案通过对所有蛋白质的无偏向性吸附,不仅确保鉴定结果的稳定性与一致性,同时显著降低对生物样本量的需求,为微量样本的蛋白质组学分析提供了高效可靠的技术支持。









