

英文标题:Pre-Analytical Drivers of Bias in Bead-Enriched Plasma Proteomics
中文标题:血浆蛋白组学中磁珠富集前分析阶段偏差的影响因素
Matthias Mann是当今国际蛋白组学的大神级人物。其高足Philipp E. Geyer是人类血浆蛋白组计划(HPPP)的主要负责人。今天让我们跟随两位专家的脚步,深入了解血浆蛋白组学的影响因素与造成偏差的原因。
研究背景
血液作为临床研究中重要的样本类型,在生物标志物研究领域(如早期疾病诊断和预后指导应用等)中具有重要的研究价值。近年来,商业化的Somascan和Olink技术与基于肽段检测的质谱技术等检测方法已经应用于大队列血浆蛋白质组研究中。
遇到的主要困境包括:
1. 血液样本的复杂性:各种蛋白的含量动态范围跨越了12个数量级;
2. 低丰度蛋白的检出存在偏差或漏检;
3. 大队列检测仪器系统的稳定性;
4. 前处理方法不一,数据标准化与批次校正并不能解决所有偏差;
5. 血浆样本通常在常规临床实践中以不同的处理条件收集,在病例对照研究中,样本收集或处理的系统差异可能导致错误的生物标志物候选物。
文章表明,约一半已发表的血浆蛋白质组学研究可能受到此类样本相关质量问题的影响。本研究旨在全面评估五种不同的血浆蛋白质组学工作流程在分析前各种因素方面的表现。
具体目标包括:
1. 系统评估每个工作流程检测低丰度蛋白质的能力;
2. 表征它们对常见样本污染物(如血小板、红细胞和外周血单核细胞)的敏感性;
3. 研究标准临床离心方案和采血试管对血浆蛋白质组分析的影响,揭示样本制备参数与蛋白质组组成之间的关系;
4. 探讨污染样本是否可以通过额外的处理步骤“挽救”;
为基于磁珠的工作流程的潜力和局限性提供见解,并为前瞻性研究设计和存档样本的回顾性质量评估提供实用指导。
研究方法
实验设计:
比较5种不同的血浆蛋白质组学工作流程,所有流程均在安捷伦Bravo液体处理平台上实现自动化,以确保96个样本的可重复性和高通量并行处理。在液相色谱-质谱(LC-MS)方面,采用了将Evosep色谱系统与Orbitrap Astral耦合的先进工作流程。
具体工作流程如下:
1. 纯血浆工作流程:作为基线方法,采用简单的蛋白质变性后进行酶消化,优化了速度和简便性;
2. 基于高氯酸沉淀中和的方法(PCA-N):通过蛋白质的溶解度进行分离,对某些污染物具有抗性,用于在不使用磁珠的情况下实现更深入的蛋白质组覆盖;
3. 三种基于磁珠的富集方法:使用具有代表性表面化学性质的磁性或非磁性磁珠。
加标实验:
使用各种血细胞类型(如血小板、红细胞和外周血单核细胞)以及整个酵母蛋白质组进行精心设计的加标实验,以系统评估每个工作流程检测低丰度蛋白质的能力,并表征它们对常见样本污染物的敏感性。此外,还研究了标准临床离心方案和采血试管对血浆蛋白质组分析的影响,以揭示样本制备参数与蛋白质组组成之间的关键关系。同时,探讨是否可以通过额外的处理步骤来改善污染样本的分析结果。
研究结果
1、不同工作流程对低丰度蛋白质的检测能力
研究建立了一个多维度、系统化的实验框架,旨在评估5种血浆蛋白质组学处理流程在不同前处理变量下的性能。5种流程包括:①简便的直接血浆法(neat workflow),未经任何蛋白富集方法;②抗污染能力较强的PCA-N流程,经过高氯酸沉淀并中和;③两种基于磁性磁珠的富集方法(强阴离子交换磁珠SAX与硅胶涂层磁珠Sera Sil 700);④一种基于非磁性磁珠的富集方法(non-magnetic beads)。这些流程代表了不同的检测深度、速度与污染敏感性之间的权衡。
本部分结果明确指出,不同流程通过各自的蛋白富集与选择性去除机制,重塑了血浆蛋白丰度的等级结构,有效压缩了极端的动态范围,其中磁珠法表现出更强的低丰度蛋白检出能力(但易受到血小板和PBMC污染的系统偏差影响),而PCA-N表现较温和但更稳定(图1)。
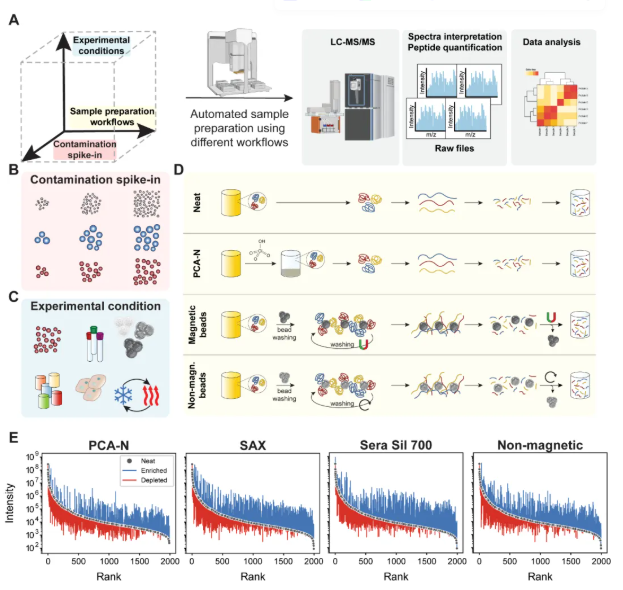
图1. 用于比较血浆蛋白质组学工作流程的系统实验框架
2、细胞污染分析
研究通过向纯净血浆中添加不同数量的红细胞、血小板和PBMC,系统评估了5种蛋白质组学流程对细胞污染的敏感性。结果表明,磁珠法极易受到污染影响,即使低水平的PBMC(140 cells/μL)也能显著增加蛋白鉴定数,某些条件下总检出蛋白数高达8000–10000种。而PCA-N流程对红细胞污染高度耐受,在不同污染浓度下保持稳定的蛋白数(约800–900种)。neat流程对红细胞污染敏感,对血小板污染抗性较强。为定量评估污染影响,研究建立了血小板、红细胞和PBMC的高特异性蛋白标志物panel,并据此计算“污染指数”(contamination index)和“细胞富集分数”(cellular enrichment score)。结果显示,非磁性磁珠法的污染指数最高,磁珠法次之,而PCA-N和neat流程对污染反应较弱。总体而言,磁珠法在检测灵敏度与污染易感性之间存在明显权衡,需特别重视样本质量控制(图2)。
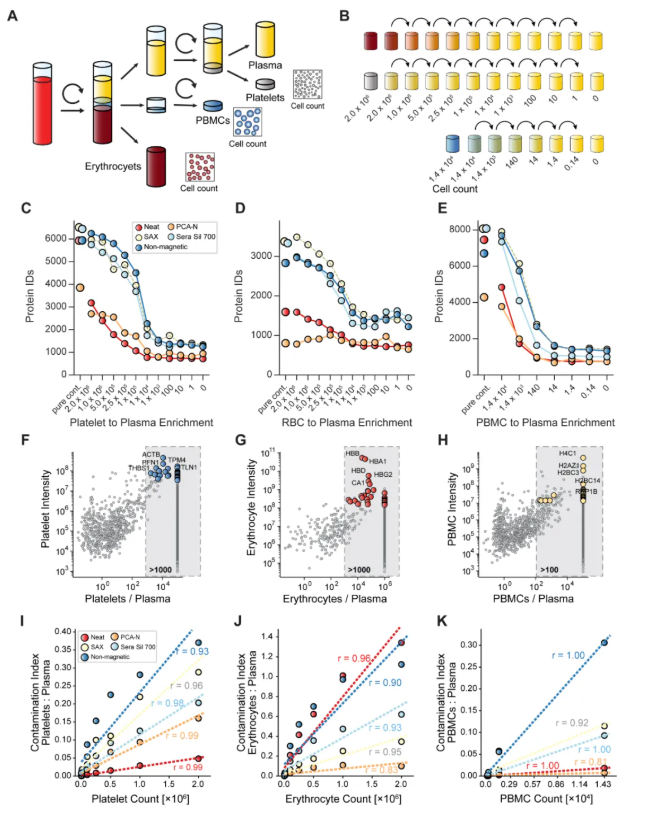
图2. 细胞污染对血浆蛋白质组学工作流程影响的系统分析
3、酵母蛋白外源添加实验:低丰度蛋白检测能力评估
为评估各流程对低丰度蛋白的检测能力,研究人员向血浆中加入了不同比例的酵母蛋白(图3)。结果显示,三种磁珠法(SAX、Sera Sil 700和non-magnetic beads)在1:100稀释条件下可鉴定2,286种酵母蛋白,显著优于PCA-N(471种)和 neat流程(317种),其中non-magnetic beads表现最优。
进一步分析代表性蛋白(如TDH3、RNQ1、FAB1)表明,磁珠法能在更低浓度下保持良好检测,将浓度检测下限提升至neat流程的100倍(如磁珠法可检测0.01%酵母浓度,neat流程为1%)。不过,PCA-N虽稳定但变异较大,neat流程则对低丰度蛋白检测能力有限。
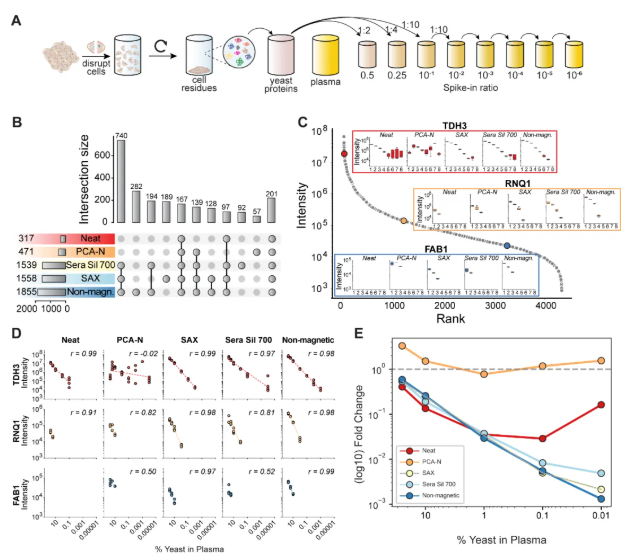
图3. 酵母蛋白加标在血浆蛋白质组学工作流程中的分析
4、血小板活化与磁珠敏感性机制探讨
为揭示磁珠法对血小板污染高度敏感的机制,研究比较了8种不同表面化学的磁/非磁珠与7种缓冲条件的组合,形成56种实验条件(图4)。结果显示:非磁珠在HEPES缓冲液中鉴定蛋白最多,但也表现出最高的血小板富集水平,可能源于其需额外离心步骤带来血小板共沉淀。在检测血小板活化方面,部分条件(如CaCl2、低pH的TFA缓冲液)诱导血小板释放特异蛋白(如PF4V1、PPBP),提示样本制备本身可激活血小板。而非磁珠在PBSC缓冲中则表现为高血小板蛋白信号而非活化释放,说明部分富集源于物理保留而非生物过程。这些发现强调了样本处理方式对血小板相关偏差的影响。
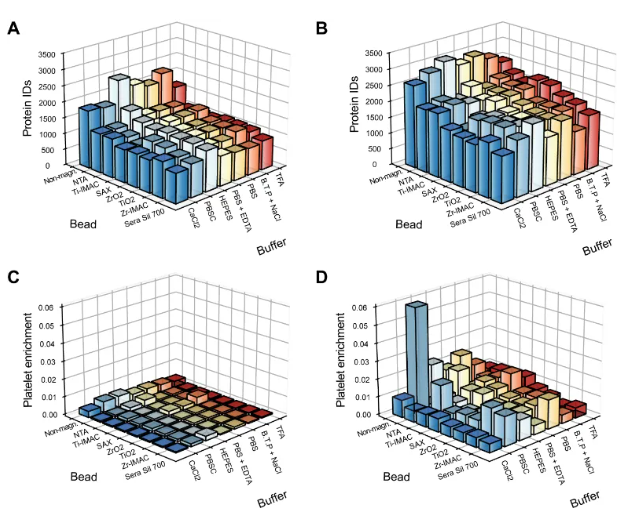
图4. 纯血浆和血小板污染血浆中珠子与缓冲液组合的分析
5、血小板污染样本的“补救”策略评估
考虑到实际临床样本常含血小板污染,研究测试了冻融循环与离心处理是否能补救,实验表明(图5),磁性磁珠法污染最重,蛋白鉴定数由1400提升至2700,即使离心后仍仅下降15–20%;而非磁性磁珠法污染更严重但可缓解更多(降至约2000)。neat流程稳定性较高,PCA-N流程鉴定数增幅35%但变化小于磁珠法。主成分分析表明,血小板污染是蛋白组变化的主要驱动因素,冻融循环影响极小。离心处理可以较稳定地降低血小板标志物强度。这些结果为处理存储样本提供参考。

图5. 血浆处理策略评估以应对血小板污染
6、推荐的血浆样本制备条件
在血浆蛋白组学研究中,前分析阶段的样本处理条件(如离心设置和试管类型)对污染水平和蛋白质组谱影响显著。研究显示,低转速离心时,凝胶试管因凝胶屏障未充分激活,血小板、红细胞等污染显著高于标准试管,且基于磁珠的富集方法鉴定的蛋白质数量远高于常规法和PCA-N法。提高离心力和时间可有效降低污染。主成分分析表明,离心是影响蛋白质组谱的主要因素,磁珠工作流程按离心力明显聚类,而PCA-N对处理差异敏感性低。
抗凝剂类型对磁珠工作流程影响显著:EDTA血浆中磁珠法鉴定的蛋白质数最高,但血小板和红细胞污染也最严重,而Li-肝素和血清样本污染更少。因此,研究建议标准化抗凝剂类型,避免混合使用不同基质样本,且高转速离心可作为血浆蛋白组学,尤其是磁珠富集法的优选样本处理条件,以减少污染偏差。

图6. 离心条件对血浆蛋白质组分析的影响
研究结论
本研究结果为在可变样本质量下评估工作流程性能提供了定量框架,并为临床蛋白质组学研究中的生物标志物发现和质量控制提供了指导。
具体结论如下:
1. 基于磁珠的富集方法虽然能提高低丰度蛋白质的检测能力,但对血小板、PBMC等血细胞污染敏感,使用时需谨慎控制样本质量;
2. 高氯酸沉淀中和(PCA-N)方法对红细胞污染具有高度抗性,对血小板衍生的污染具有一定耐受性,可作为一种可靠的替代方法;
4. 优化样本处理(如离心条件、抗凝剂选择等)可以部分减轻分析前偏差的影响;
5. 研究鉴定出的大量蛋白质组为进一步的生物标志物研究提供了丰富的资源。









