

英文标题:Integrative single-cell metabolomics and phenotypic profiling reveals metabolic heterogeneity of cellular oxidation and senescence
中文标题:整合单细胞代谢组学和表型分析揭示细胞氧化和衰老的代谢异质性
发表期刊:nature communications
影响因子:14.7
1
研究背景
在生命科学领域,细胞的复杂性与异质性备受关注。单细胞分析技术的发展,让科学家对单细胞遗传学、蛋白质组学和代谢组学的异质性有了更深入的研究,在胚胎发育、癌症、衰老等方面成果显著,凸显出细胞异质性研究的重要性。细胞代谢对细胞功能和命运影响重大,但现有多数代谢组学研究集中于匀浆水平,无法揭示单细胞代谢异质性及机制。虽然单细胞质谱技术有所发展,却难以将代谢与细胞的氧化、衰老等表型联系起来,限制了对细胞代谢和功能的深入理解。跨模态分析整合单细胞组学与细胞功能或表型,为细胞异质性研究带来新契机。以Patch-seq技术为例,其在糖尿病研究中发挥重要作用,揭示了细胞功能与基因表达谱的关联。在其他细胞研究中,跨模态分析也贡献突出。基于此,本研究将单细胞质谱与活细胞成像技术相结合,构建跨模态分析平台,旨在探究单细胞代谢组与细胞氧化、衰老状态的关联,为相关研究开辟新路径。
2
研究结果
1、SCLIMS驱动的单细胞研究:从氧化应激建模到代谢关联解析
本研究为探究单细胞代谢组与表型特征的联系,搭建起单细胞活细胞成像与质谱技术整合的跨模态分析平台(SCLIMS)。研究选用细胞氧化应激(Oxidative Stress, OS)模型,以HEK293T细胞为对象,经过氧化氢处理并恢复后,细胞活力适宜单细胞质谱(Single-Cell Mass Spectrometry, SCMS)分析。借助DCFDA染色评估细胞氧化应激水平,具体而言,先将细胞与DCFDA进行孵育,随后通过显微镜完成成像;紧接着运用微移液器结合膜片钳技术采集单细胞样本,开展单细胞质谱分析;最后将所得荧光强度数据与单细胞代谢组学特征进行精准匹配,成功构建代谢组与氧化水平的成对数据集(图1a)。
在数据分析阶段,研究人员筛选特定质荷比范围的离子信号,经数据库匹配注释和二级质谱确认,获取用于通路富集分析的代谢物。热图呈现出单细胞代谢物丰度随DCFDA荧光强度改变的情况(图1b),发现多种代谢物受DCFDA强度影响,体现出氧化应激对细胞代谢影响显著。
为验证实验准确性,研究人员采用主成分分析(Principal Component Analysis, PCA)、均匀流形近似与投影(Uniform Manifold Approximation and Projection, UMAP)和t分布随机邻域嵌入(t-distributed Stochastic Neighbor Embedding, t-SNE)等方法,对比经DCFDA处理和未处理细胞的代谢组。结果显示,两种细胞的代谢组无显著差异(图1c-e),代谢物间相关性相似(图1f)。
综上,该跨模态分析平台成功整合单细胞代谢组和细胞表型,稳定性和可靠性高,保留细胞活力和代谢功能,为后续深入研究细胞代谢与氧化应激的关系筑牢基础。
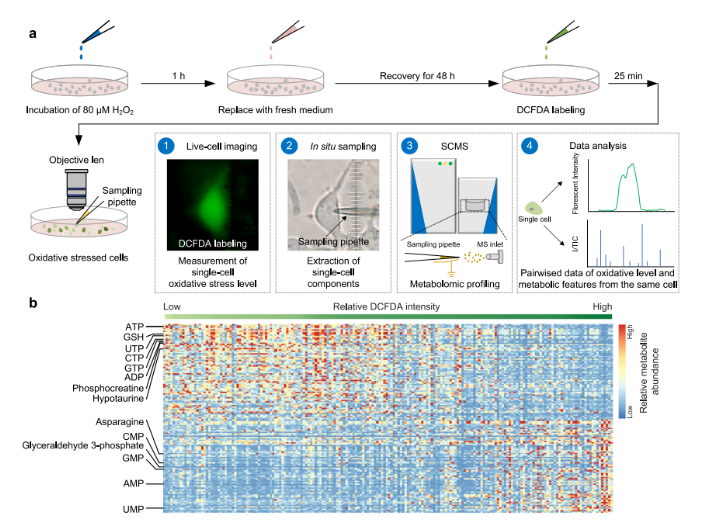
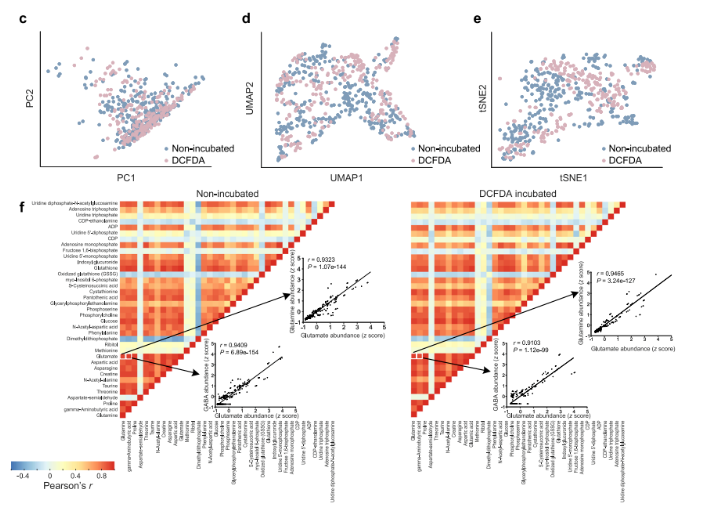
图1. 整合单细胞代谢组和细胞表型的跨模态分析平台
2、SCLIMS技术:解码单细胞代谢与氧化应激的关联密码
利用SCLIMS的多模态特性,研究通过关联单细胞代谢组学数据与DCFDA强度,系统剖析细胞代谢与氧化应激水平的内在联系(图2a)。经PCA和层次聚类分析(Hierarchical Cluster Analysis, HCA)验证代谢组学数据无批次效应后,研究发现部分代谢物丰度与DCFDA强度显著相关,如谷胱甘肽(Glutathione, GSH)含量与DCFDA强度呈负相关(图2a),印证了方法的可靠性。
对整体代谢组分析显示,多数与氧化应激相关的代谢物呈负相关,表明代谢物下调可能是氧化应激的关键特征(图2b)。与能量代谢相关的关键代谢物,随着氧化应激水平升高而减少,单细胞能量负荷与氧化应激水平的负相关关系,进一步表明氧化应激对能量代谢的干扰(图2c-h)。
通过代谢物集富集分析(Metabolite Set Enrichment Analysis, MSEA)发现,氧化应激过程中,线粒体与能量代谢、氧化还原代谢、脂质代谢、嘌呤和嘧啶代谢以及维生素代谢等多种代谢途径均受到干扰(图2i)。此外,SCLIMS还首次揭示了氨基酸代谢、糖类及其衍生物代谢等此前未被关注的代谢途径在氧化应激中的变化(图2i),表明氧化应激可显著影响蛋白质合成与降解、糖基化反应及能量代谢等多种细胞过程。
在小鼠胚胎成纤维细胞(MEFs)中应用SCLIMS开展多模态分析发现,MEFs中关键代谢物与氧化应激的相关性,以及受影响的代谢途径变化模式,均与人胚肾(HEK)细胞高度相似。这证实了SCLIMS多模态分析在不同细胞表型中的稳健性。
综上所述,基于SCLIMS的跨模态分析,深度揭示了单细胞代谢与氧化应激之间的紧密内在联系。这一发现充分凸显了整合代谢组学与细胞表型分析,对于全面理解不同细胞类型生物学过程的关键意义与重要价值。
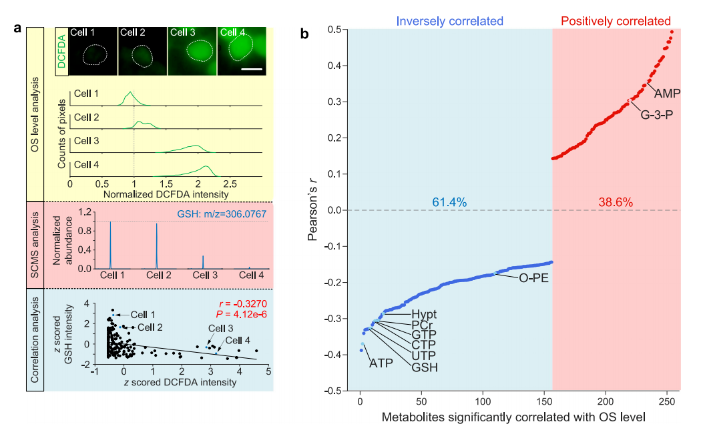
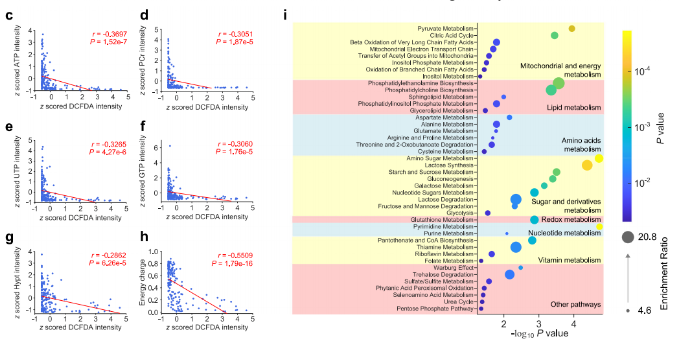
图2. 细胞内代谢组与细胞氧化应激水平的相关性分析
3、SCLIMS助力单细胞代谢剖析:氧化应激中代谢亚型的多元特征挖掘
基于SCLIMS获取的单细胞代谢组数据,通过k-中心点算法聚类分析,将细胞分为六个具有不同代谢特征的亚型(C1-C6)(图3a)。各亚型展现出不同的OS水平,可通过DCFDA强度体现(图3b)。拟时间分析显示,轨迹始于OS水平最低的C1亚型,经三个分支分别发展至代表低、中、高氧化水平的C2/C3、C4、C5/C6亚型(图3c),表明细胞OS在代谢调控下逐步变化。利用Wilcox秩和检验分析发现,各亚型具有特定代谢标志物(图3d)。对比C1与C6细胞代谢组并进行代谢物富集分析(图3e),结果显示C6细胞中脂质代谢、线粒体功能、氧化还原平衡等相关途径显著缺失或富集度低,而甘氨酸和丝氨酸代谢途径富集度高,缩醛磷脂合成途径仅在C6细胞中富集,验证了SCLIMS的可靠性。此外,SCLIMS还发现了果糖和甘露糖降解等新的OS相关代谢途径,以及C1和C6细胞间能量代谢途径的转变,表明OS过程中ATP生成效率降低。
同样地,在MEFs的研究中,同样利用SCLIMS鉴定出六种代谢亚型(M1-M6),且呈现代谢引导的OS发展轨迹。MEFs与HEK293T细胞具有相似的代谢特征,高OS水平的M6亚型中,脂质代谢、线粒体功能等相关途径同样缺失或不显著,进一步证明SCLIMS在分析单细胞代谢变化方面的稳健性。
综上,SCLIMS不仅验证了以往研究中的代谢变化,还揭示了与OS相关的新代谢途径及细胞内代谢异质性,凸显其作为单细胞水平全面分析工具的可靠性与通用性。
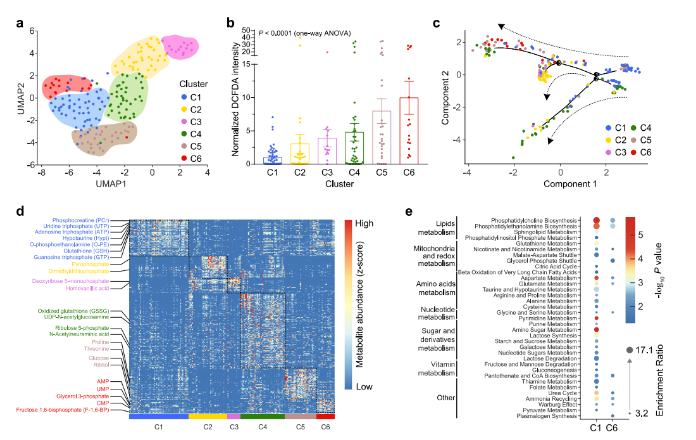
图3. 跨模态分析揭示的亚型特异性代谢特征和代谢组的动态变化
4、SCLIMS揭示了单细胞代谢组在预测细胞氧化应激状态方面的能力
尽管细胞在OS下的代谢改变与异质性已被深入研究,但代谢与细胞表型间的关联强度尚不明确。研究团队借助机器学习,探索单细胞代谢谱预测不同OS水平异质性亚型的可能性。
通过采用判别分析算法,基于单细胞代谢特征训练分类模型,旨在区分先前聚类分析中确定的6种特定OS水平的亚型(图4a)。研究将数据随机划分为训练与测试数据集,在保留所有符合标准的质荷比(m/z)信号且未进行变量选择的情况下,利用训练数据集赋予模型基于单细胞代谢组完整特征分类代谢亚型的能力,并通过测试数据集评估其性能。借助受试者工作特征(ROC)曲线和混淆矩阵分析发现,多分类中ROC曲线平均曲线下面积(AUC)表现优异,聚类预测准确率也达到较高水平(图4b-c),证实单细胞代谢谱可直接预测代谢亚型。
鉴于分类模型仅能预测代谢亚型,无法精准判断OS水平,研究进一步基于神经网络算法训练回归模型(图4d),期望利用代谢特征直接预测单细胞OS水平。同样划分数据集并构建模型后,通过与DCFDA强度关联,实现基于单细胞代谢特征的OS水平预测。测试结果显示,预测值与真实值的相关性良好(图4e)。此外,该单细胞代谢谱在小鼠胚胎成纤维细胞(MEFs)中得到验证,分类模型表现出色,预测的OS水平与真实值也呈现显著相关性。
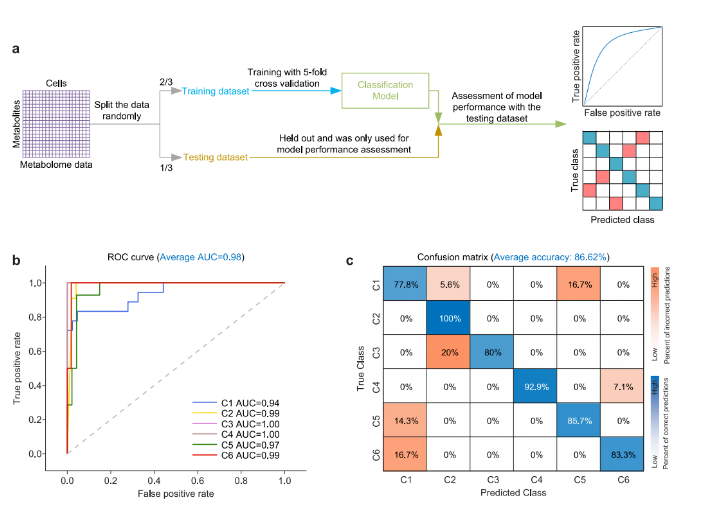
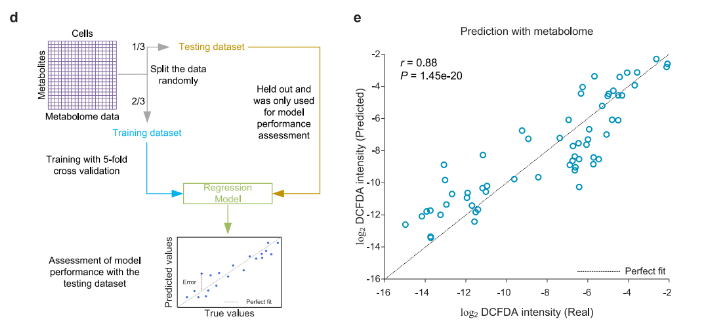
图4. 基于单细胞代谢组的机器学习引导的氧化应激水平预测
5、SCLIMS揭示基于初始细胞的代谢异质性与OS状态之间的因果关系
在细胞研究领域,OS水平异质性与代谢异质性之间的因果关联尚不清晰。研究人员猜测基线代谢谱或许会对细胞诱导OS后的表型或代谢异质性产生影响。于是,将未受过氧化氢诱导OS的细胞定义为 “初始细胞”,代表代谢和表型的基线状态,借助SCLIMS技术展开深入探究。
研究结果显示,初始细胞的OS水平异质性较低(图5a),然而其单细胞代谢组却存在异质性(图5b-c)。通过k-中心点聚类分析,基于初始细胞的代谢组学特征,识别出Cluster-I和Cluster-II两种主要代谢亚型(图5b)。机器学习表明,单细胞代谢组能够直接预测细胞亚型,有力证实了初始细胞代谢的显著异质性。对这两种亚型细胞的代谢物丰度进行差异分析,发现了如次牛磺酸、谷胱甘肽等特征代谢物(图5c)。
值得关注的是,即使初始细胞未经历OS刺激,两种亚型间的代谢差异也与不同OS水平细胞的代谢变化模式一致。经分析,Cluster-II中的细胞与高OS水平的细胞更相似,Cluster-I中的细胞则与低OS水平的细胞更为相似(图5d)。这种现象与高OS水平细胞中部分代谢物下调的情况相契合。此外,多种代谢途径在Cluster-I细胞中富含标记代谢物,但在高OS水平的C6细胞中相较于低OS水平的C1细胞均呈下调状态(图3e)。
谷胱甘肽是初始细胞代谢异质性的典型例证,如图展示出Cluster-I和Cluster-II单个细胞间GSH度的显著差异(图5e-f)。构建的代谢网络显示,两种亚型细胞中代谢物间的相关性存在差异,具有亚型特异性代谢特征。例如,Cluster-I中GSH与多种代谢物密切相关,而Cluster-II中与之显著相关的代谢物较少(图5g)。通过DyNet算法计算发现,GSH是重连程度最高的代谢物,在代谢组中连接其他代谢物时发挥着关键作用(图5h)。
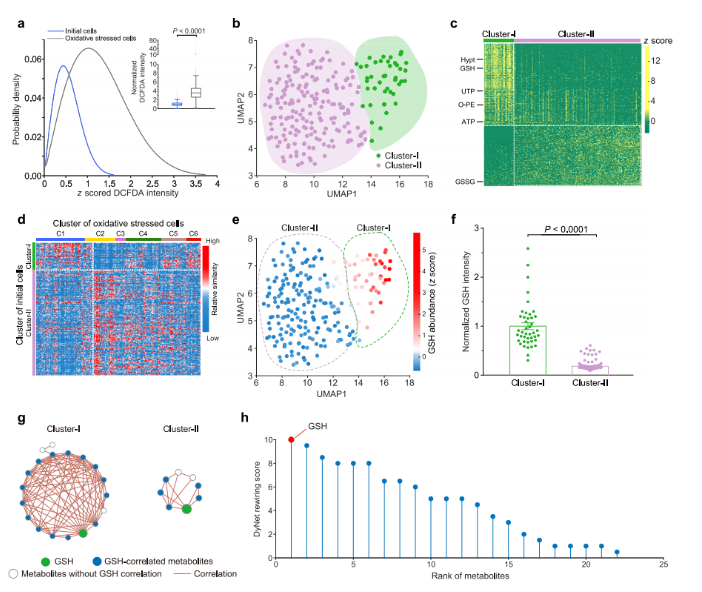
图5. 初始细胞中的代谢异质性
6、细胞的代谢异质性决定了它们在OS下的衰老命运
OS常引发早衰,这是关键的细胞衰老类型。研究旨在寻找能区分两种不同代谢亚型细胞的活细胞探针,以探究其在OS诱导衰老中的命运。因两种代谢亚型细胞的谷胱甘肽(GSH)水平存在差异(图5e),研究尝试利用细胞内GSH水平来区分它们。
研究人员挑选出GSH水平处于不同范围(5%-50%)的初始细胞,将其与其他初始细胞一同映射到UMAP投影图上,计算不同GSH水平细胞与相应代谢亚型(聚类I/II)的匹配比例(图6a)。当选取的高/低谷胱甘肽水平细胞占比超过15%时,正确匹配比例大幅下降,表明仅5% - 15%范围内的细胞能较好代表相应代谢亚型的代谢组,反映细胞对OS的抗性或敏感性(图6b-g)。为保证实验稳定性,研究人员选取GSH水平最高和最低的5%的细胞,分别命名为 “代谢组类似抗OS细胞(C1)的初始细胞”(MROR细胞)和 “代谢组类似对OS敏感细胞(C6)的初始细胞”(MROS细胞)。
随后,研究人员运用活细胞GSH荧光染料(mClB)和荧光激活细胞分选技术(FACS)分离MROR和MROS细胞(图6h)。分离前,MROR和MROS细胞的DCFDA强度差异较小,但诱导OS后,MROS细胞的DCFDA强度显著高于MROR细胞(图6i-j),这表明MROS细胞的OS状态加剧。同时,SA-β-半乳糖苷酶(SA-β-Gal)染色结果(图6k-l)进一步证实MROS细胞在OS诱导衰老中的敏感性。
综上,基于SCLIMS技术获得的数据表明,初始细胞的代谢特征很可能决定其在OS及OS诱导衰老过程中的命运。
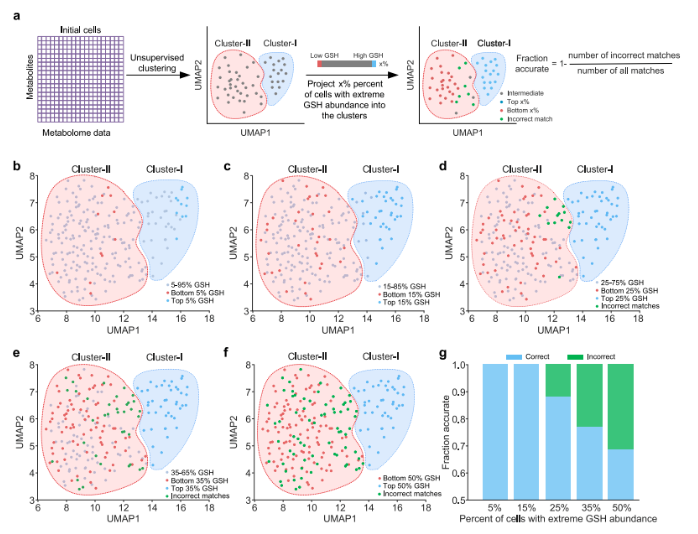
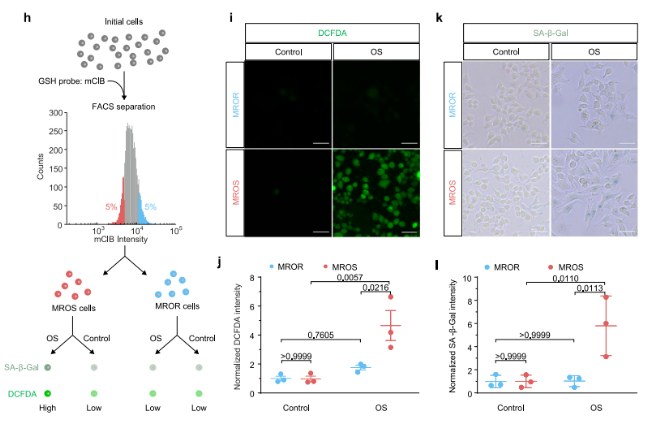
图6. 细胞内代谢特征在决定细胞在氧化应激及氧化应激诱导的衰老过程中命运的作用
7、通过SCLIMS鉴定出的关键代谢物可减轻氧化应激和细胞衰老
研究发现,SCLIMS鉴定出的关键代谢物下调或许是引发OS的因素之一,这意味着针对性补充代谢物或能逆转OS及OS诱导的细胞衰老。为此,研究人员选取了次牛磺酸(hypotaurine)、磷酸肌酸(phosphocreatine)和O-磷酸乙醇胺(O-phosphoethanolamine)三种关键代谢物开展实验。这三种代谢物在OS状态下含量下降(图2b),在不同代谢亚型(C1-6)中呈异质性分布(图3d),还可作为区分不同命运初始细胞的代谢标记物(图5c)。
用这三种代谢物处理细胞后,细胞内OS水平下降,通过细胞内DCFDA荧光强度降低可证实这一点(图7a-b)。鉴于OS是细胞衰老的常见诱因且在自然衰老中作用关键,研究人员探究了这些关键代谢物对OS诱导的细胞衰老的影响。SA-β-Gal染色结果(图7c-d)显示,这三种代谢物显著减轻了细胞衰老。同时,这些代谢物缓解了细胞生长停滞(图7e-f),恢复了在细胞OS过程中受损的线粒体膜电位(Mitochondrial Membrane Potential, MMP)(图7g-h)。在氧化应激条件下对小鼠胚胎成纤维细胞(MEFs)检测发现,使用这三种关键代谢物也得到类似结果,表明它们在多种细胞类型中普遍适用。综上所述,SCLIMS技术鉴定出的代谢物可通过降低OS水平、缓解细胞衰老发挥保护作用。
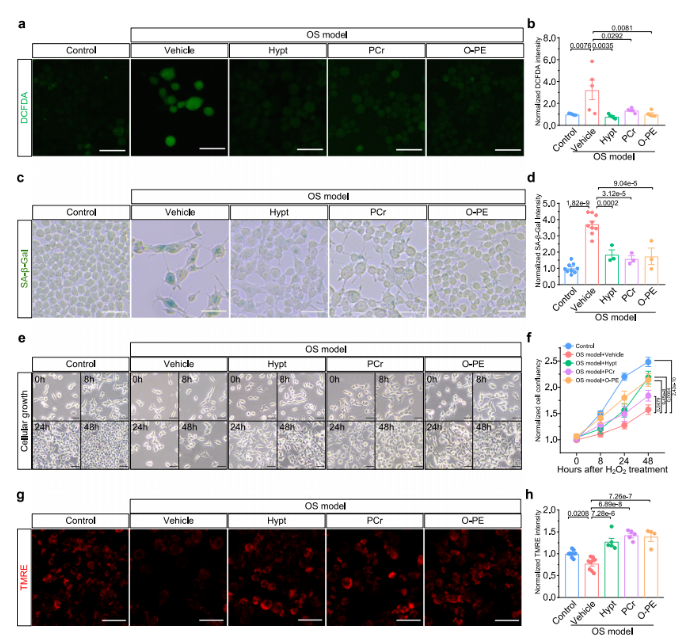
图7. 关键代谢物对氧化应激和诱导衰老的影响
8、通过SCLIMS鉴定出的具有保护作用的代谢物可促进健康衰老并延长寿命
在确认关键代谢物对两种不同细胞类型的氧化应激和衰老具有调节作用后,研究人员进一步探究其对动物衰老的影响,为此引入秀丽隐杆线虫衰老模型(图8a)。在秀丽隐杆线虫L4阶段及整个生命周期,向其生长培养基中添加不同浓度的次牛磺酸、磷酸肌酸和 O-磷酸乙醇胺这三种关键代谢物,然后评估线虫的氧化应激水平、寿命和健康状况。
研究发现,添加这些关键代谢物显著延长了线虫寿命(图8b)。通过DHE染色评估发现,老年线虫氧化应激水平较高,而补充关键代谢物可缓解这一情况(图8c-d)。在运动能力方面,衰老会使线虫活动能力下降,表现为摆尾频率降低和自由移动速度减慢,补充关键代谢物能改善这些状况(图8e-h)。
综上,经SCLIMS鉴定的这些关键代谢物,在秀丽隐杆线虫中展现出通过预防细胞氧化应激和衰老,进而延长寿命、促进健康衰老的潜力。
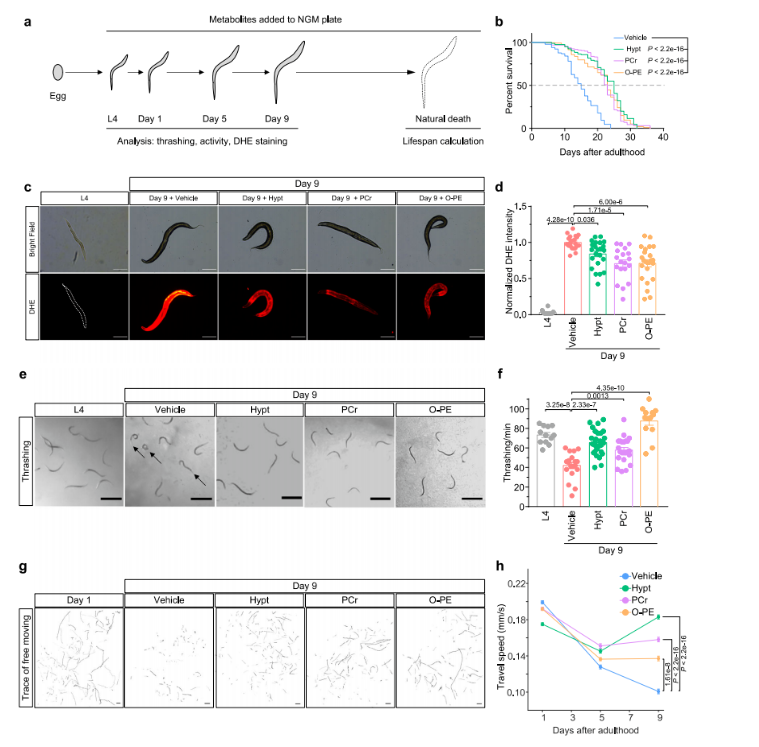
图8. 代谢干预可延长秀丽隐杆线虫的寿命并促进其健康衰老
3
研究结论
本研究借助单细胞活细胞成像与质谱技术(SCLIMS),深入剖析细胞代谢组与氧化应激及衰老的关联。研究发现,细胞代谢组存在显著异质性,由此划分出的不同代谢亚型细胞,其氧化应激水平各异,特定代谢标记物可用于预测细胞对氧化应激的抗性或敏感性,进而揭示初始细胞代谢组差异或决定其在氧化应激下的命运。实验证实,补充次牛磺酸、磷酸肌酸和O-磷酸乙醇胺等关键代谢物,不仅能降低细胞内氧化应激水平、减轻细胞衰老、恢复线粒体功能,还可调节细胞代谢组,使其趋近于未受氧化应激细胞的状态。在秀丽隐杆线虫衰老模型中,这些关键代谢物同样展现出延长寿命、缓解氧化应激、改善运动能力的效果。研究成果揭示了细胞代谢在氧化应激和衰老进程中的关键作用,为衰老干预及相关疾病研究提供了新方向。









