
英文标题:Comprehensive Investigations of MUC1 O Glycosylation Process Reveal Initial Site Preference by the Polypeptide GalNAc Transferases
中文标题:对MUC1 O-糖基化过程的综合研究揭示了多肽GalNAc转移酶的初始位点偏好
发表期刊:ACS Catalysis
影响因子:13.1
研究背景
黏蛋白型O-糖基化(O-GalNAc糖基化)是一种广泛存在于治疗性蛋白(如疫苗、细胞因子、肽激素)中的翻译后修饰,其位点和结构的特异性对糖蛋白的半衰期、免疫原性及药代动力学具有显著影响。该过程由人类多肽N-乙酰-α-半乳糖胺转移酶(GalNAc-Ts)家族启动,通过将GalNAc基团连接到底物蛋白的丝氨酸(Ser)或苏氨酸(Thr)残基上实现。然而,由于GalNAc-Ts家族成员众多(共20种)且同工型间存在功能冗余与特异性,其对靶蛋白的糖基化位点选择及调控机制仍有待深入解析。
MUC1作为一种典型的O-糖蛋白,其N端串联重复序列中含有多个潜在O-糖基化位点,分布于GSTA、GVTS和PDTRP等基序中。研究表明,MUC1的异常O-糖基化是上皮细胞肿瘤的重要特征,与免疫调节密切相关,且其糖基化位点和类型的多样性使其成为肿瘤疫苗开发的关键靶点。但目前针对GalNAc-Ts对MUC1的位点特异性研究有限,仅少数真核来源的 GalNAc-Ts(如T2、T1、T3、T4)的体外活性被报道,且其糖基化顺序和位点偏好存在差异。
此外,GalNAc-Ts的原核表达长期面临挑战,限制了对其功能的系统研究。因此,建立高效的表达系统以获取活性GalNAc-Ts,并全面解析其对MUC1的初始糖基化位点偏好、催化机制及调控因素,对于理解MUC1糖基化的生物学功能及推动O-糖基位点特异性MUC1疫苗的开发具有重要意义。
研究结果
1、利用细菌表达系统表达功能性重组人源GalNAc-Ts
在利用细菌表达系统表达功能性重组人源GalNAc-Ts方面,研究者基于已建立的GalNAc-T2细菌表达系统,通过删除N端跨膜结构域和部分茎区、进行密码子优化构建GalNAc-Ts(图1B),并在大肠杆菌氧化性细胞质中与人类蛋白二硫键异构酶(Protein Disulfide Isomerase, PDI)共表达(图1C),最终纯化获得19种GalNAc-T成员(GalNAc-T8除外)(图1D)。
这些GalNAc-Ts在相同条件下表达水平差异显著(10 mg/L至10 μg/L),且其表达水平与理化性质(蛋白质等电点、分子量、预测溶解度)、培养物细胞密度及翻译时密码子使用频率均无明显关联,因此推测差异可能与mRNA二级结构、稳定性及翻译速率有关。
为检测催化活性,研究者以三种裸黏蛋白肽(MUC1a、EA2、MUC5Ac)和一种Thr7位点修饰GalNAc的糖肽EA2-Tn为底物(图1A-E),在UDP-GalNAc存在下进行体外糖基化反应,经高效液相色谱分离产物后发现:14种GalNAc-Ts对至少一种测试肽有可检测活性,其中T1、T3、T6、T13对裸肽和糖基化肽均高活性;T2、T4等7种仅对三种裸肽有活性;T7、T10、T20偏好糖基化肽(图1E);而T8、T9等6种无催化活性。综上,该细菌表达平台成功表达19种人类GalNAc-T成员,其中14种对黏蛋白衍生肽高活性。
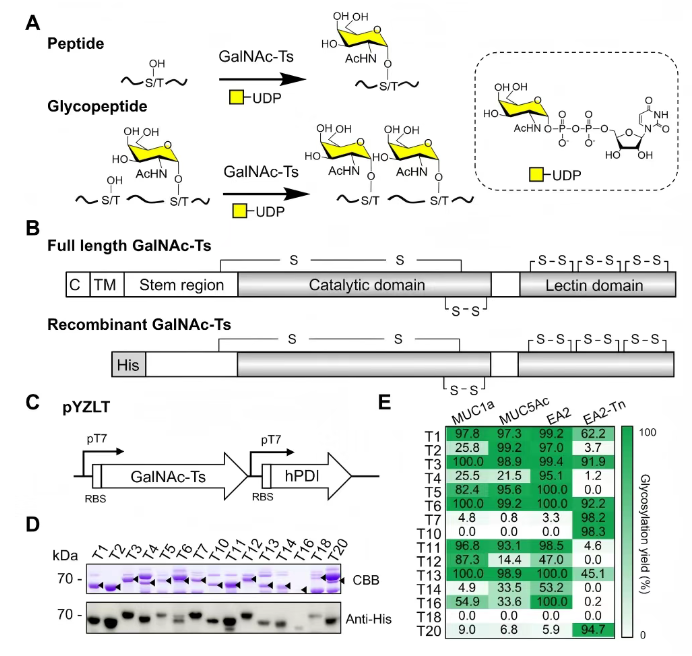
图1. 基于细菌平台的人源GalNAc-Ts表达
2、GalNAc-Ts对MUC1表现出独特且重叠的O-糖基化位点偏好
为评估GalNAc-Ts对MUC1上5个潜在O-糖基化位点的偏好性,研究者合成含一个MUC1串联重复序列的23肽(MUC1-PAP,序列为PAPGS⁵T⁶APPAHGVT¹⁴S¹⁵APDT¹⁹RPAP),将其与14种有活性的GalNAc-Ts以1:2000的酶与底物比例孵育12小时。结果显示,T1、T2、T3等9种可转化近95%的裸MUC1-PAP为糖肽,T4和T14仅修饰20-30%的底物,而T7、T10、T20因严格识别糖肽底物未产生明显产物(图2A)。
后续LC-MS/MS分析发现,14种GalNAc-Ts同工型中10种可催化MUC1-PAP上至少两个位点,即GSTA基序的Thr6和GVTS基序的Thr14,体现出功能冗余性(图2A)。其他位点中,T1、T2等修饰GSTA基序的Ser5,仅T4和T12催化GVTS基序的Ser15,T3、T6、T4可糖基化PDTRP基序的Thr19(虽有报道称HEK293细胞中仅T4可修饰该位点)。
五个潜在位点中,Thr6和Thr14的O-糖基化占有率最高,其次是Ser5,Ser15和Thr19修饰丰度低(图2B)。GalNAc-Ts对Thr6和Thr14的高冗余活性表明,GSTA和GVTS基序的修饰是MUC1的主要糖基化形式。
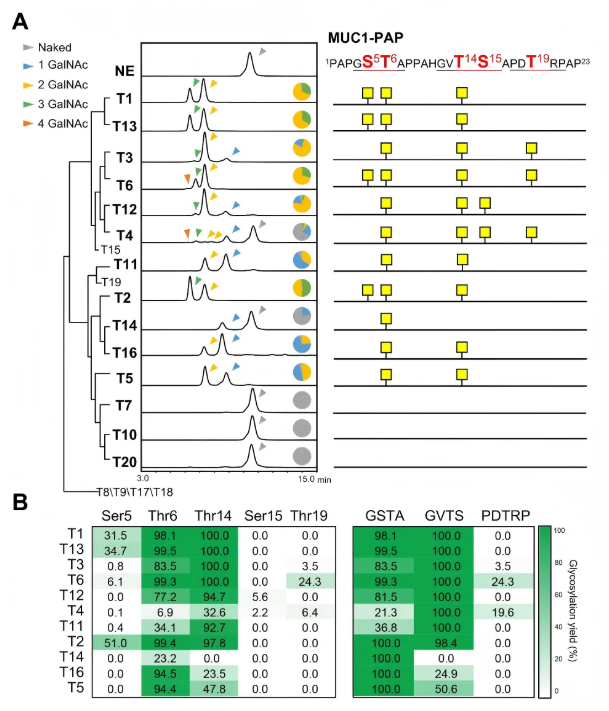
图2. GalNAc-Ts对MUC1-PAP的位点特异性O-糖基化作用
3、GalNAc-Ts对MUC1的时序性O-糖基化过程
为全面了解GalNAc-Ts催化MUC1-PAP的O-糖基化过程,研究者通过LC-MS/MS测定不同时间间隔的糖基化中间体,发现11种GalNAc-Ts同工型优先在Thr6或Thr14位点启动反应(图3A),据此将其分为两簇:簇1(T1、T13等7种)优先靶向GVTS基序的Thr14位点,簇2(T2、T14等4种)初始靶向GSTA 基序的Thr6位点(图3A),且这种分类与该家族系统发育树分析结果高度一致。
深入研究显示,簇1中T1、T13、T11按Thr14→Thr6→Ser5顺序添加GalNAc(图3B);T12则优先在Ser15位点引入第三个GalNAc(图3B);T3、T4、T6因可修饰PDTRP基序的Thr19位点而各有两条催化途径(图3C),其中仅T4能修饰所有5个潜在位点。
簇2成员途径更保守,T2、T14等均按Thr6→Thr14顺序修饰,仅T2可进一步修饰Ser5位点(图3D)。综上,不同GalNAc-T同工型催化特性既有保守性又有差异性,在底物修饰中具有协同互补功能。

图3. GalNAc-Ts对MUC1的O-糖基化位点加工过程
4、GalNAc-T簇位点特异性偏好的结构基础与相互作用分析
为解析GalNAc-Ts簇的位点特异性偏好,以T1(簇1)和T2(簇2)为代表,构建了T1Thr6、T1Thr14、T2Thr6和T2Thr14四种复合物模型(图4A)。分子动力学模拟显示,T1Thr14和T2Thr6的复合物稳定,亲核试剂与异头碳(C1)距离合理(约4埃),而T1Thr6和T2Thr14因O-C1距离波动大无活性。肽段稳定性分析表明,T1Thr14和T2Thr6中肽段更稳定,与凝集素和催化结构域的近距离相关(图4D)。关键活性位点残基分析显示,T1Thr14和T2Thr6中残基溶剂可及表面积更小(图4E),结合更紧密,其中非保守残基(T1的T350、I362;T2的H365、F377)可能调控底物特异性(图4B-F-H)。

图4. 分子动力学模拟揭示T1和T2的位点特异性糖基化偏好
5、GalNAc-Ts催化反应机制的量子力学解析
通过量子力学计算研究T1Thr14和T2Thr6的糖基化机制(图5A-B)。结果显示,T1通过两个过渡态(TS1、TS2)形成氧鎓离子中间体(IM),而T2仅一个过渡态(类似T1的TS1)且无中间态,但二者催化机制相似,过渡势垒相当(T1为14.4 kcal/mol,T2为12.4 kcal/mol)。这表明T1的IM为瞬态,进一步支持了不同GalNAc-T同工型催化特性的保守性与差异性。
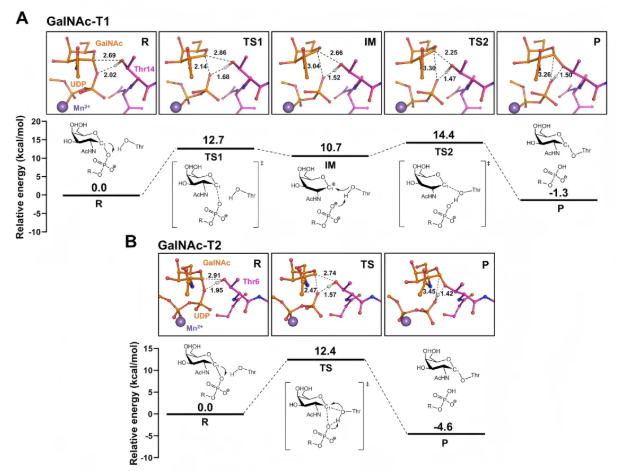
图5. 通过量子力学计算获得的GalNAc-T1和-T2的反应机制
6、肽结合口袋中的关键残基影响初始位点选择
为验证活性位点残基功能,研究通过交换T1和T2的相应残基,构建了四种单突变体(T1T350H、T1I362F、T2H365T、T2F377I)和两种双突变体(T1T350H/I362F、T2H365T/F377I),并检测其对MUC1-PAP的催化活性及O-糖基化位点偏好性。结果显示,T1的单突变体仍偏好Thr14位点(图6A-B),双突变体则切换为Thr6位点(图6A-B);T2双突变体将偏好从Thr6位点切换为Thr14位点,单突变体仍靶向Thr6位点(图6A-B),且所有T2突变体酶活性增强,二糖肽(P₇.₃₀)和三糖肽(P₆.₄₃)产量增加(图6A),表明这两个非保守位点对初始O-糖基化位点偏好起决定性作用。
序列比对显示,簇1对应残基含短且非芳香族侧链,簇2偏好芳香族残基(图6C),提示这些残基在调控GalNAc-Ts底物特异性上可能有保守功能。
此外,构建凝集素结构域截短体(T1ΔLD、T2ΔLD)的研究表明,其初始O-糖基化位点偏好与野生型一致,但T1ΔLD催化活性降低,T2ΔLD活性增强,说明凝集素结构域参与调控催化反应,且对不同GalNAc-T成员的酶活性影响有差异。
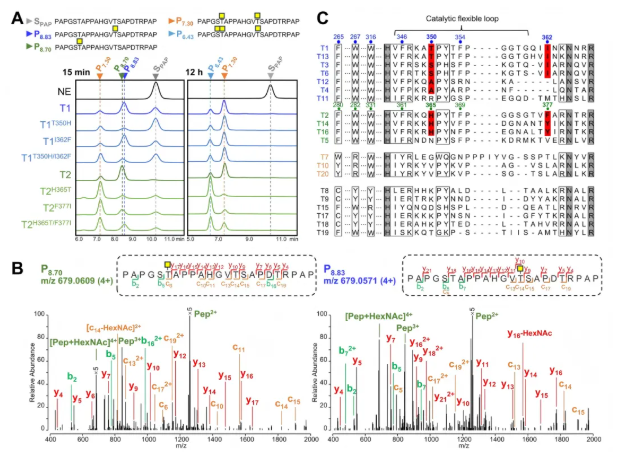
图6. 肽结合口袋中的关键残基控制GalNAc-T1和-T2在MUC1上的初始O-糖基化位点偏好
7、MUC1序列变化对GalNAc-Ts糖基化偏好的影响及基序特异性验证
为探究MUC1结构和序列变化对O-糖基化位点偏好的影响,研究选用与MUC1-PAP长度相同但序列模式不同的MUC1-PAH肽段(图7A)。结果显示,T1和T2对MUC1-PAH的初始糖基化位点分别为GVTS基序的Thr6和GSTA基序的Thr18,与MUC1-PAP的偏好一致,其他簇成员也呈现类似趋势(图7B),表明GalNAc-Ts的底物特异性由O-糖基化位点周围的侧翼序列决定。此外,T2突变体在MUC1-PAH中可切换初始位点(图7B),进一步证实相关残基对位点选择的关键作用。
通过合成含GSTA、GVTS、PDTRP基序的七肽验证发现,多数GalNAc-Ts高效糖基化前两者的苏氨酸,仅T4可修饰PDTRP基序(图7C),证实GalNAc-Ts对GSTA和GVTS基序的保守偏好,而PDTRP基序需特定同工型,这对癌症疫苗设计和糖基化调控机制研究具有重要意义。
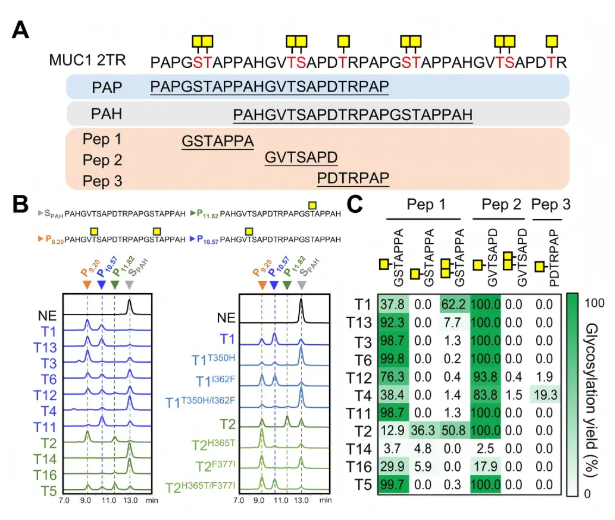
图7. GalNAc-Ts的O-糖基化位点偏好取决于靶标丝氨酸/苏氨酸残基周围的侧翼序列环境
研究结论
该研究围绕GalNAc-Ts的底物特异性及O-糖基化位点偏好性展开,通过分子动力学模拟、量子力学计算、突变体实验及序列分析等方法,探究了其调控机制。研究发现,T1和T2等GalNAc-Ts的初始O-糖基化位点偏好由肽结合口袋中的关键非保守残基(如T1的T350、I362和T2的H365、F377)决定,这些残基在各自簇内具有保守的理化性质;凝集素结构域也参与催化反应调控,且对不同GalNAc-T成员影响有差异。此外,GalNAc-Ts对MUC1中的GSTA和GVTS基序存在保守偏好,其底物特异性主要由O-糖基化位点周围的侧翼序列决定,而PDTRP基序的糖基化需特定同工型。这些发现为癌症疫苗设计及糖基化调控机制研究提供了重要见解。










