

英文标题:Polysaccharides from hawthorn fruit alleviate high-fat diet-induced NAFLD in mice by improving gut microbiota dysbiosis and hepatic metabolic disorder
中文标题:山楂多糖通过改善肠道菌群失调和肝脏代谢紊乱缓解高脂饮食诱导的小鼠非酒精性脂肪肝
发表期刊:Phytomedicine
影响因子:8.3
浙江大学药学院、浙江中医药大学基础医学院等研究团队携手,在Phytomedicine杂志发表研究成果,该研究发现山楂多糖能够通过改善肠道菌群失衡与肝脏代谢异常,进而缓解高脂饮食引发的小鼠非酒精性脂肪肝(NAFLD)。
研究背景
非酒精性脂肪肝(Non-Alcoholic Fatty Liver Disease, NAFLD)是与高脂饮食、代谢综合征密切相关的慢性肝病,肠道菌群失调和肝脏代谢紊乱是其重要发病机制。山楂多糖(Hawthorn Polysaccharides, HP)作为天然活性成分,虽有降脂、抗炎等潜在作用,但其抗NAFLD的具体机制尚未明确。本研究以高脂饮食诱导的NAFLD小鼠为模型,结合体内外实验、代谢组学及16S rRNA测序技术,系统探究HP对肝脂肪堆积、炎症反应、肠道菌群组成及肝脏代谢通路的调控作用,旨在揭示HP通过“肠道菌群-肝脏代谢轴”缓解NAFLD的科学机制,为NAFLD的天然药物干预提供新靶点和理论依据。
研究结果
1、山楂多糖(HP)的基本结构和理化性质表征
山楂多糖(HP)的基本结构和理化性质表征结果如下:其分子量为1.281×105 kDa(图1a)。FT-IR光谱(图1b)显示,3405 cm-1附近的强吸收峰表明存在大量-OH官能团及羟基间的氢键缔合;2935 cm-1处为碳水化合物的特征吸收峰,提示有饱和C-H键拉伸振动;1600-1800 cm-1处为C=O拉伸振动;1413 cm-1处源于C-H键变形振动;800-1200 cm-1为碳水化合物指纹区,1078 cm-1信号表明存在吡喃糖(糖苷),900 cm-1附近的峰则显示β型糖苷键为主要形式。单糖组成以葡萄糖(56.44%)、半乳糖醛酸(13.51%)和阿拉伯糖(12.91%)为主,还含果糖、甘露糖等其他8种单糖。LC-MS分析(图2)检测到多种糖苷键,如2,X-f-ara、3,5-f-ara等,且不含T-Gala。流变学特性方面(图1c-f),HP在高角频率下因多糖链弛豫受限而更粘稠,剪切应力与应变呈正相关的幂函数关系,粘度与剪切速率呈负相关的幂函数关系,表现出剪切变稀行为。
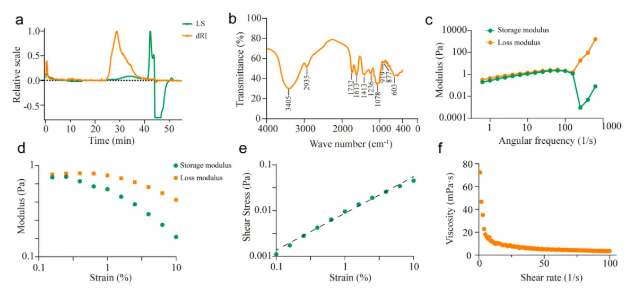
图1. 山楂多糖(HP)的表征
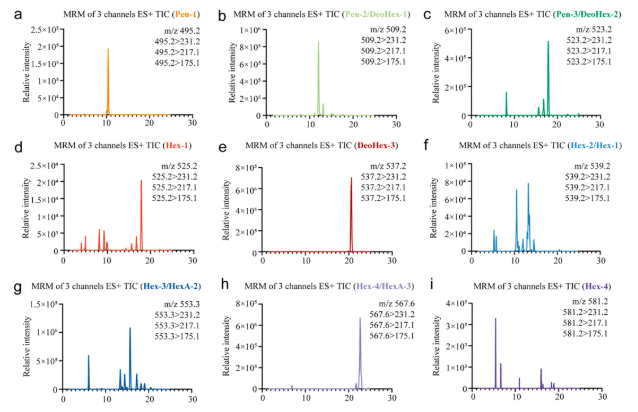
图2. 山楂多糖糖苷键连锁分析的总离子色谱图(TIC)和MRM色谱图
2、HP减轻NAFLD小鼠病理状态
动物实验程序如图3a所示,每周监测小鼠体重,结果高剂量(HPH)和低剂量(HPL)组均显著抑制NAFLD小鼠体重增加(图3b)。此外,HPH组与模型组相比,血清ALT和AST水平显著下降,而HPL组仅与模型组相比,ALT显著下降,AST无显著差异(图3c-d)。这些结果表明HP对NAFLD小鼠肝功能有一定的保护作用。
观察小鼠肝脏中脂肪的堆积情况(图3e-f),HE染色结果显示,模型组与对照组相比有大量脂肪空泡,而HPL和HPH组都在一定程度上减少了脂肪空泡的产生。同样,与对照组相比,模型组有大量红色染色的脂滴,在HPL和HPH组明显减少。这些结果表明,HP有效地限制了高脂饮食诱导的NAFLD小鼠肝脏脂肪的堆积。
氧化应激和炎症通常与NAFLD有关,高剂量和低剂量的HP都减少了脂质过氧化产物MDA的积累,减轻了肝脏抗氧化酶SOD的异常降低(图3g-h)。此外,肝脏中的炎症细胞因子IL-1β和IL-6也同样受到抑制(图3i-j)。
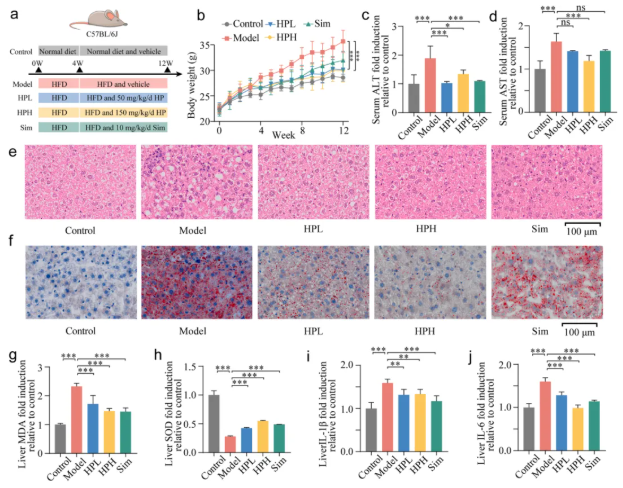
图3. HP对高脂饮食诱导的NAFLD小鼠NAFLD相关病理指标的影响
3、HP改善NAFLD小鼠肝脏代谢紊乱
利用代谢组学研究了不同组小鼠肝脏内源代谢产物的变化(图4)。PCA评分图中,每个实验组与模型组和对照组表现出明显的分离,表明药物治疗改变了NAFLD小鼠的肝脏代谢。在比较HPL组和HPH组时,观察到HPH组的PCA评分点更接近对照组,表明高剂量HP对肝脏代谢谱有更好的优化。
在负离子模式下,HPL组和HPH组的PCA评分点与模型组明显远离,并与对照组部分重叠,表明HP部分恢复了NAFLD小鼠的肝脏代谢,使之趋于正常。HPH组与对照组的重叠度高于HPL组,与模型组的距离更大,表明高剂量HP的作用更强。在正离子和负离子模式下均鉴定了差异代谢物,这些代谢物的KEGG分析如图4e-f所示。热图显示了每组中这些代谢物的相对丰度(图4g-h)。KEGG结果显示氨基酸合成和代谢途径发生了显著变化,包括苯丙氨酸、酪氨酸、色氨酸、丙氨酸等。此外,在正离子模式下观察到神经鞘脂代谢和初级胆汁酸生物合成的显著变化,在负离子模式下观察到亚油酸代谢的显著变化,反映了小鼠肝脏脂质代谢的显著变化。
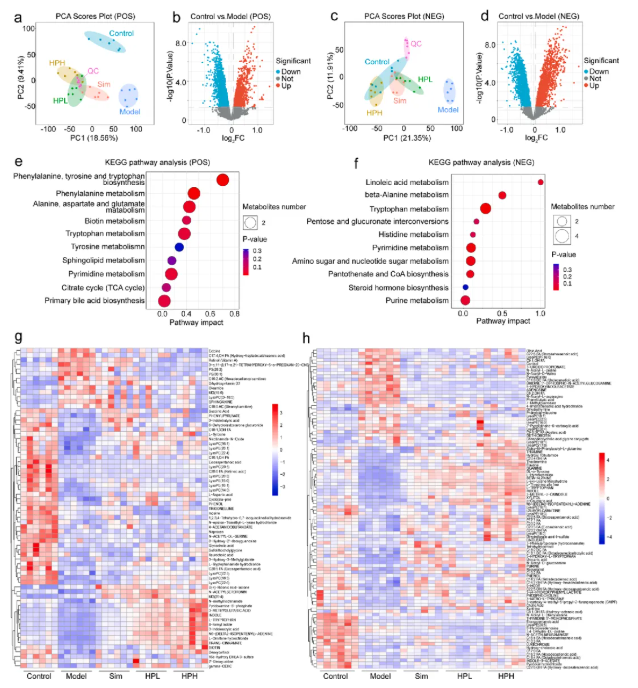
图4. HP对高脂饮食诱导的NAFLD小鼠肝脏代谢谱的影响
4、HP可缓解与NAFLD相关的某些代谢物的异常
为进一步研究HP对NAFLD相关关键代谢物的特异性调节作用,12种代表性化合物的相对丰度如图5所示。模型组中l-酪氨酸、5-羟基-l-色氨酸(色氨酸的衍生物)和组氨酸转化为谷氨酸的中间体尿刊酸显著降低,而高剂量HP治疗使其水平恢复正常(图5a-c)。
与氨基酸代谢物中观察到的趋势相反,模型组中十一碳的二羧酸十一烷二酸显著升高,但HPH治疗显著抑制了这种升高(图5d)。脂肪酰胺油酰胺在所有组中表现出与十一烷二酸相似的变化模式(图5e)。作为一种必需的类固醇激素,皮质醇水平在模型组中异常高,但高剂量HP治疗有效地将其降低到正常水平(图5f)。此外,NAFLD小鼠肝脏中升高的腺苷水平在高剂量HP治疗后下降到控制水平以下(图5g)。对照组、模型组和HPH组腺苷的平均相对强度分别为8.8×104、1.6×105和1.5×104。维生素水平在不同组之间也有显著变化,包括视黄醇(维生素A)和生物素(维生素B7)。维生素A在模型组升高,但高剂量HP将异常积累的维生素A降低到正常水平(图5h)。相比之下,维生素B7水平在模型组降低,但在HPH组显著升高(图5i)。三种胆汁酸:胆酸、牛磺胆酸和甘胆酸在NAFLD小鼠肝脏中均显著降低,HPH仅对胆酸异常水平有明显的恢复作用(图5j-l)。
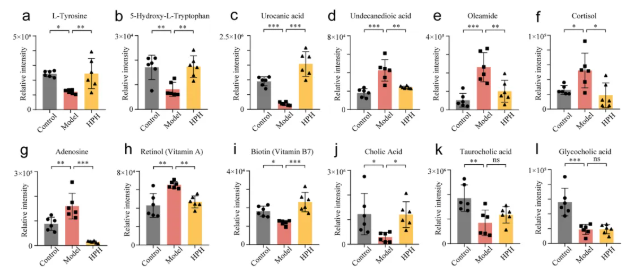
图5. HP对高脂饮食诱导的NAFLD小鼠肝脏代表性内源性代谢物的影响
5、HP改善NAFLD小鼠肠道菌群失调
本研究选取药效更优的HPH组,采用16S rRNA测序技术分析对照组(Control)、模型组(Model)和HPH组小鼠的肠道菌群组成。OTU水平的PcoA分析(图6a)和层次聚类树分析(图6b)显示,三组肠道菌群组成存在显著差异,证实高脂饮食诱导的NAFLD小鼠肠道菌群组成与健康小鼠相比发生改变,且HP处理对NAFLD小鼠肠道菌群组成有显著影响,提示其在恢复肠道菌群平衡以治疗NAFLD方面具有潜在作用。
三组检测到的基因片段以维恩图呈现(图6c):对照组的1044个基因片段中,39.18%未在模型组中检测到,反映了NAFLD状态下肠道菌群的变化;模型组中29.19%的基因片段在HPH组中缺失,表明HP对肠道菌群有显著调节作用;此外,HPH组存在186个对照组和模型组均未检测到的特有基因片段。属水平组成热图(图6d)显示,不同组中部分菌属的总体丰度存在差异。综上,高脂饮食喂养和高剂量HP干预均导致小鼠肠道菌群组成发生实质性改变,提示HP可能通过调节肠道菌群缓解NAFLD。
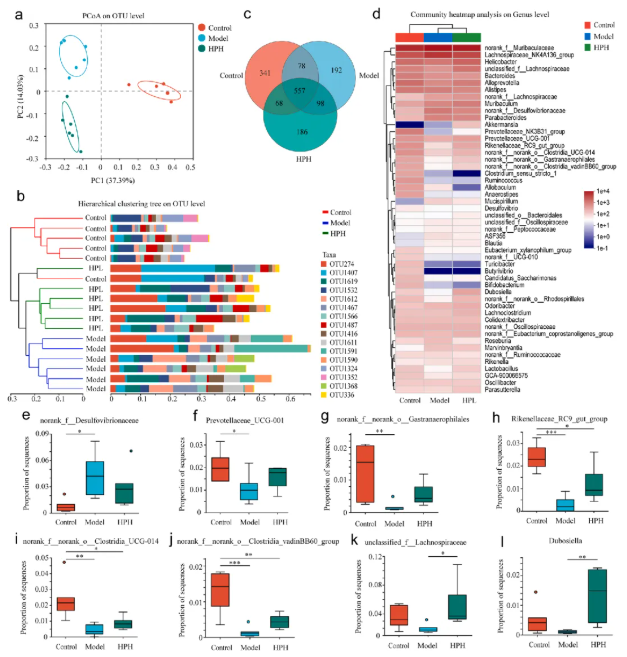
图6. HP对高脂饮食诱导的NAFLD小鼠肠道微生物群的影响
6、HP增加NAFLD小鼠肠道醋酸含量
肠道菌群失调常伴有短链脂肪酸(SCFAs)的减少。为探讨NAFLD小鼠肠道SCFAs的变化及HP的影响,测定了四种常见的SCFAs:乙酸、丙酸、丁酸和戊酸(图7a)。所有四种SCFAs在对照组中发现较高水平,而在模型组中显著降低。虽然HPH组中这些SCFAs的平均水平高于模型组,但从统计学上讲,只有乙酸在HPH组中显著升高(图7b)。
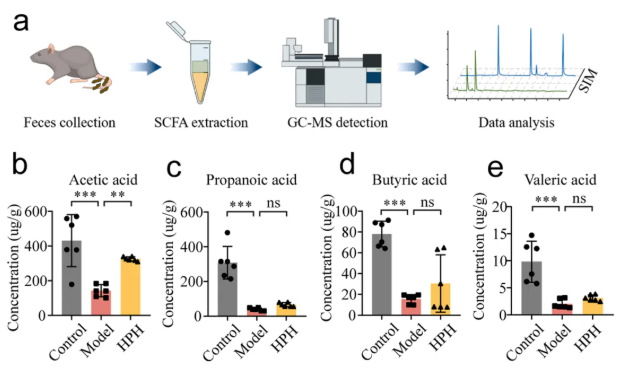
图7. HP对高脂饮食诱导的NAFLD小鼠肠道SCFAs的影响
7、HP调控代谢物与细菌属的相关性分析
为了研究HP对NAFLD小鼠肠道菌群失调的恢复是否也影响肝脏代谢产物,对12个NAFLD相关代谢物丰度和肠道菌属做了相关性分析。总体分析如图8a所示,|R|>0.06和p<0.05的结果被认为是显著相关(图8b-k)。相关分析结果表明,HP可能通过调节肠道菌群的紊乱来缓解NAFLD小鼠肝脏的代谢紊乱,例如HP可能通过显著增加NAFLD小鼠体内Dubosiella菌的丰度来缓解肝脏腺苷水平。
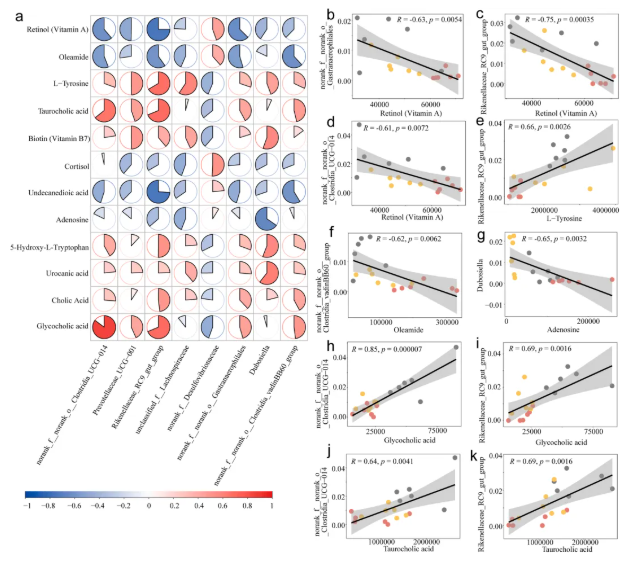
图8. 代表性代谢物与肠道细菌属的相关性分析
研究结论
本研究提取、纯化并分析了山楂多糖的理化性质、单糖组成和糖苷键结构。体内实验显示,HP减轻了高脂饮食诱导的NAFLD小鼠的病理状况。代谢组学分析显示,NAFLD小鼠肝脏代谢异常显著,HP治疗部分改善。关键的内源性代谢途径,包括氨基酸、脂质和维生素,表现出显著改善。此外,该研究还调查了高剂量HP对NAFLD小鼠肠道微生物群组成的影响。粪便中短链脂肪酸的检测结果表明高剂量HP治疗后醋酸水平显著增加。代谢产物和细菌属之间的相关性分析表明,关键的NAFLD相关代谢产物和肠道微生物群之间存在很强的关联,表明HP对肠道微生物群的调节作用与其恢复肝脏代谢紊乱有关。总之,本研究从代谢组学和肠道微生物学的角度全面阐明了HP治疗NAFLD的治疗机制。









