
文章标题:Brown-fat-mediated tumour suppression by cold-altered global metabolism
发表期刊:Nature
影响因子:69.504
作者单位:复旦大学上海医学院
百趣生物提供服务:中心碳高通量靶标检测
近日,瑞典Karolinska Institutet 的Yihai Cao院士课题组与复旦大学、山东大学、温州医科大学等高校的科研人员合作,在Nature上发表了题为"Brown-fat-mediated tumor suppression by cold-altered global metabolism"的研究成果,揭示了低温暴露通过激活褐色脂肪组织,改变整体代谢来抑制肿瘤生长的机制,并提出了相应的恶性肿瘤治疗新思路。百趣生物为本次研究提供了中心碳代谢相关代谢组学检测分析服务。
中国工程院外籍院士、瑞典卡罗林斯卡医学院Yihai Cao教授为该工作的通讯作者。瑞典卡罗林斯卡医学院的Takahiro Seki博士和复旦大学基础医学院细胞与遗传医学系杨云龙研究员为本文共同第一作者。
下面就和小趣一起来围观挨冻的小白鼠们吧!(PS:研究表明挨冻还可以减肥哟,不想运动的小伙伴们,行动起来吧!)

代谢重整是癌症的标志性特征之一,表现为葡萄糖的高摄取。在有氧条件下,癌细胞利用糖酵解途径,快速分解葡萄糖,产生少量ATP和大量乳酸,为其生长、侵袭和转移提供物质和能量基础,即有氧糖酵解,也称“Warburg effect”。
褐色脂肪组织(BAT)是哺乳动物中对维持体温起重要作用的特异性产热组织。低温暴露、饮食和药物干预可激活BAT,通过将氧化磷酸化过程中的电子传递过程与ATP的生成解偶联,从而将线粒体跨膜质子梯度势能转化为热能,这一过程即为非战栗性生热(Non-shivering thermogenesis, NST)。BAT介导的NST是一种有效的能量消耗机制,可降低肥胖和糖尿病动物的体重并改善代谢功能障碍。由于成年人体内有丰富的褐色脂肪组织,BAT激活产热为治疗肥胖和2型糖尿病提供了一种非常有吸引力的方法。而本篇文章阐明了低温暴露诱导褐色脂肪组织激活,改变整体代谢从而抑制实体瘤生长的生理机制。
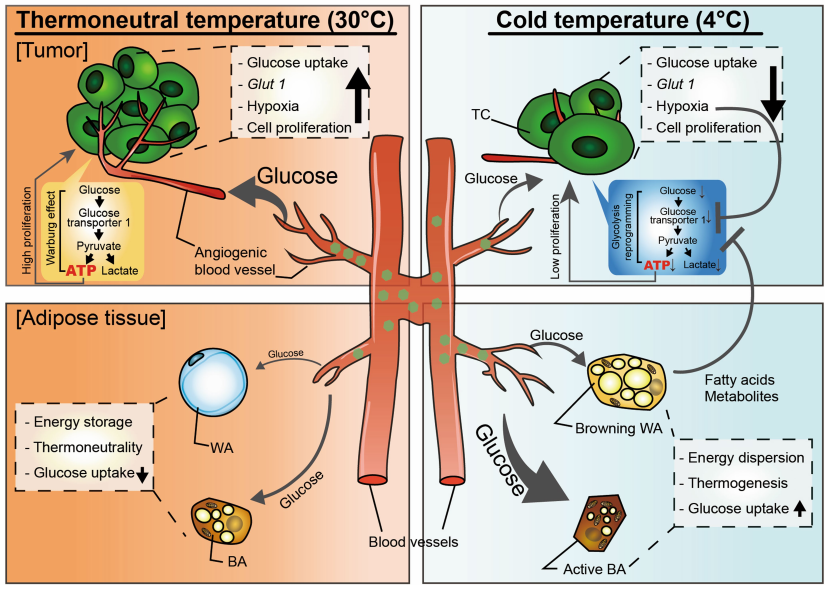
低温暴露诱导的肿瘤抑制和存活
恶性肿瘤被认为是一种代谢紊乱病,大多数实体瘤通过加速糖酵解代谢(即Warburg效应)获得生长和发展所需的能量。而脂质代谢的激活可引起肿瘤代谢途径的重排,进而改变肿瘤生长率、扩散潜能和药物反应。为了研究脂肪组织产热相关代谢对肿瘤生长和肿瘤宿主存活的影响,研究人员首先测试了低温暴露对肿瘤生长和发展的影响。
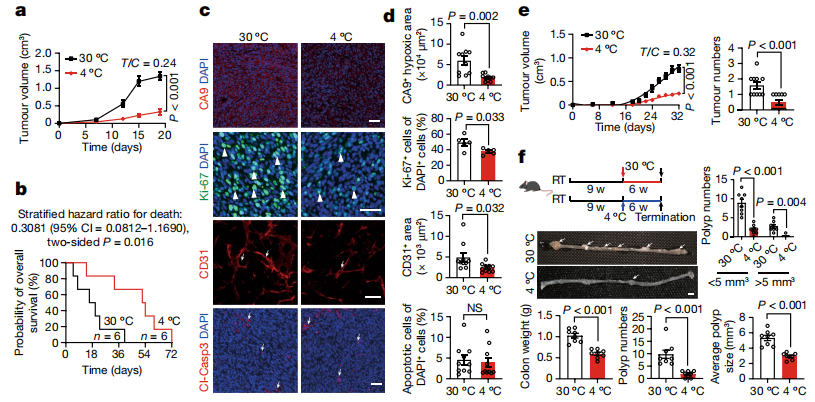
将结直肠癌(CRC)皮下植入C57BL/6小鼠中,与30℃下的小鼠相比,在4℃条件下其肿瘤生长表现出明显的抑制效果。如图所示,低温暴露诱导的肿瘤抑制非常明显,而且低温停止后,低温暴露对肿瘤生长的抑制是可逆的。研究人员进一步验证了其他癌症类型中低温诱导的肿瘤抑制,在包括纤维肉瘤、乳腺癌、黑色素瘤和胰腺导管腺癌等动物模型中,低温暴露也显著抑制了这些肿瘤的生长速率。与之一致,4℃条件下结直肠癌荷瘤小鼠的存活时长几乎翻了一倍。免疫组化分析表明,低温暴露改善了结直肠癌肿瘤组织中的缺氧条件。在纤维肉瘤、乳腺癌、黑色素瘤和胰腺癌等多种皮下肿瘤模型实验中也观察到了类似的结果。研究人员还在两种遗传自发肿瘤模型(MMTV-PyMT乳腺癌,ApcMin/+肠腺瘤)中进一步验证了低温暴露诱导肿瘤抑制。
在皮下肿瘤模型中,低温暴露可能通过降低皮下部位的局部温度抑制肿瘤生长。研究人员在免疫缺陷小鼠肝组织中,也重现了低温诱导的肿瘤抑制。这些发现排除了低温通过皮肤接触直接诱导肿瘤抑制的可能性。
低温诱导褐色脂肪组织激活和白色脂肪组织褐变
既然低温并不直接诱导肿瘤抑制,那它是通过怎样一种机制发生的呢?组织学和免疫荧光染色结果表明,与无肿瘤小鼠相似,异种移植和遗传自发荷瘤小鼠中的褐色脂肪组织表现出高度密集的结构,表现为较小的多房结构,这是BAT激活的典型形态学表型。与表型改变一致, 线粒体COX4+含量和CD31+微血管密度在冷习服下的褐色脂肪组织中显著增加。解偶联蛋白(UCP1)是一种关键的产热蛋白,与无瘤小鼠一致,其表达水平在荷瘤小鼠的BAT中也有相应增加。这表明,将肿瘤植入小鼠不会显著影响低温触发BAT激活。
众所周知,低温暴露也会激活白色脂肪组织,尤其是皮下白色脂肪组织(sWAT),并表现出褐变表型。结果表明肿瘤不会干扰sWAT褐变。
通过PET-CT成像分析,发现在热中性条件下,在异种移植和自发肿瘤模型中,18F-FDG分布主要积聚在肿瘤组织中,在BAT中信号较低。而低温暴露明显刺激了18F-FDG向BAT中富集,在肿瘤中刚几乎检测不到信号。定量分析进一步验证了低温诱导18F-FDG在iBAT和肿瘤之间重新分布的结论。以上结果表明,低温暴露可能是通过刺激BAT增加葡萄糖摄取,从而减少肿瘤组织的葡萄糖摄取量。
肿瘤抑制依赖褐色脂肪组织
众所周知,冷习服可加速小鼠的产热代谢,那么低温暴露对荷瘤小鼠产热代谢的影响是怎样的呢?耗氧量测试表明相对于热中性组,低温暴露增加了结直肠癌荷瘤小鼠的代谢。在异种移植和自发肿瘤模型中,低温暴露荷瘤小鼠的空腹血糖水平显著降低。胰岛素耐量和葡萄糖耐量试验表明,低温暴露下胰岛素敏感性和快速葡萄糖清除率显著提高。这些实验表明,低温暴露显著降低了荷瘤小鼠的血糖水平并提高了胰岛素敏感性。
为了确证BAT激活在肿瘤抑制中的作用,研究人员通过外科手术切除了荷瘤小鼠中的褐色脂肪组织。发现切除BAT显著增加了4℃下的血糖水平,表明BAT的激活是血糖消耗的主要因素。更重要的是,去除BAT几乎消除了冷习服对肿瘤的抑制作用。相反,在热中性条件下,去除BAT对肿瘤生长没有影响。这些结果表明,BAT的激活是低温诱导肿瘤抑制的主要原因。去除BAT也显著促进了肿瘤缺氧、血管生成和肿瘤细胞增殖。除异种移植的结直肠癌模型外,在乳腺癌遗传自发肿瘤模型中也验证了以上结果,低温诱导的血糖含量降低也被拉回到热中性水平。这些数据提示了褐色脂肪组织依赖的肿瘤抑制机制。
肿瘤中的代谢重整
切除BAT消除低温诱导的肿瘤抑制揭示我们,低温条件下BAT激活可能会改变肿瘤代谢。通过RNA测序(RNA-seq)进行的基因集富集分析(GSEA)表明,低温暴露的CRC肿瘤中的糖酵解和脂质代谢均减弱。靶向代谢组学分析显示,低温暴露的结直肠癌荷瘤小鼠的褐色脂肪组织中糖酵解显著增加。糖酵解途径的几个关键中间体,包括葡萄糖-1-磷酸、葡萄糖-6-磷酸、果糖-1,6-二磷酸、甘油醛-3-磷酸、3-磷酸甘油酸、2-磷酸甘油酸,磷酸烯醇式丙酮酸,丙酮酸和乳酸等均显著增加了。
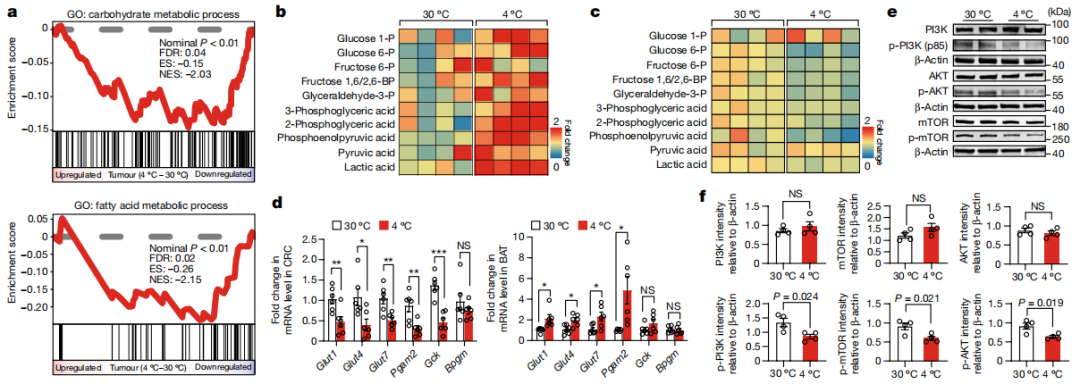
进一步实验表明,在低温暴露的肿瘤组织中,包括Glut1、Glut4和Glut7在内的葡萄糖转运体的转录表达水平显著降低。与之相反,褐色脂肪组织中Glut4和糖酵解相关基因显著升高。与抑制肿瘤糖酵解一致,低温暴露也显著抑制了CRC肿瘤中磷脂酰肌醇-3-激酶(PI3K)、热休克蛋白(AKT)和哺乳动物雷帕霉素靶蛋白(mTOR)的激活。在低温暴露黑色素瘤中也发现类似的PI3K激活抑制。这些数据表明,低温暴露通过抑制糖酵解途径改变了肿瘤中的代谢重整,从而对肿瘤的能量供应与生长产生影响。
高糖饲养可恢复肿瘤生长
Ucp1缺失消除肿瘤抑制
既然褐色脂肪组织竞争性抑制肿瘤组织的血糖摄取,而激活的褐色脂肪组织大量摄取血糖用于非战栗性生热,Ucp1则是脂肪组织中负责非战栗性生热(NST)的关键线粒体蛋白,通过Ucp1缺失小鼠实验可进一步阐述低温诱导肿瘤抑制机制。在野生型(WT)小鼠中,低温暴露显著降低了小鼠体重而Ucp1缺失消除了这种效应。同时Ucp1缺失也消除了低温暴露的肿瘤抑制效应。与此一致,UCP1蛋白缺失显著减少了冷习服下的产热。PET-CT扫描分析显示Ucp1缺失鼠中,低温暴露组的BAT中葡萄糖摄取不显著,而其肿瘤组织的葡萄糖摄取不受影响。
Ucp1缺失鼠4℃组中的肿瘤、BAT和sWAT大小与30℃组中的相似。类似地,Ucp1缺失将肿瘤细胞增殖和缺氧提升至热中性水平。靶向代谢组学分析表明有氧肿瘤糖酵解在Ucp1缺失鼠中基本恢复。这些发现支持了UCP1介导的机制对于肿瘤抑制至关重要的推论。
癌症患者的褐色脂肪组织激活
为了验证动物模型结果,研究人员进行了人体实验。健康志愿者(22-25周岁男性和女性各3名)穿着单衣,每天在16℃微冷环境中停留2-6小时。连续14天后,PET-CT扫描发现,志愿者锁骨上、颈部和胸骨旁的双侧区域显示出明显的BAT激活。验证了成年男性和女性人体中存在大量褐色脂肪组织,并且其被可耐受的低温暴露激活。
研究人员进一步对一名18岁的霍奇金淋巴瘤患者进行了初步研究。让该患者穿着轻薄的衣服,在22℃的轻度低温环境中生活7天后,PET-CT扫描显示锁骨上、颈部和胸骨旁的双侧区域存在大量激活的BAT,并大量摄取18F-FDG。而该患者回到28℃温暖环境中4天后18F-FDG摄取和BAT激活明显减少。成像分析证实纵隔区存在淋巴瘤,且温暖环境下18F-FDG摄取明显提高。这些初步人体实验表明:
(1)成年人体内存在大量褐色脂肪组织;
(2) 轻度可耐受的低温暴露后,褐色脂肪组织可被激活;
(3)癌症患者体内褐色脂肪组织也被低温暴露激活;
(4)癌症患者暴露于轻度寒冷条件下显著降低了肿瘤组织中的葡萄糖摄取。
综上,暴露于生理上可耐受的低温环境下,激活褐色脂肪组织启动产热代谢,竞争性抑制肿瘤组织有氧糖酵解,从而抑制肿瘤生长。这一结果为癌症治疗提供了一种全新的概念,显然这种治疗方法简单、成本效益高,几乎在所有医院甚至在家中都是可行的,并且很可能适用于所有癌症类型。虽然这一概念还需要大量严格设计的临床研究进行验证,但也为饱受病痛折磨的癌症患者带来一丝希望,带来一线光明。让我们共同期待癌症被“冻饿而死”的一天吧!
文献下载链接:
https://pan.baidu.com/s/1HcuyHZazgU2DbHCYV8iKQg
提取码:0000









