
2020国自然 | 代谢组学和蛋白质组学等四大组学概况一览
发布时间 2022-03-09

2020年国家自然科学基金简况
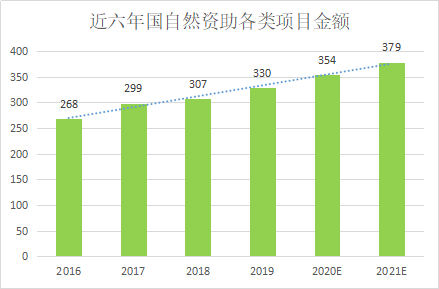
依据国家自然科学基金委员会官网2016-2019年度报告显示,我们国家每年国自然资助金额增长约7.2%,小趣预测2020年国自然资助总金额约354亿元,2021年将达到379亿元。
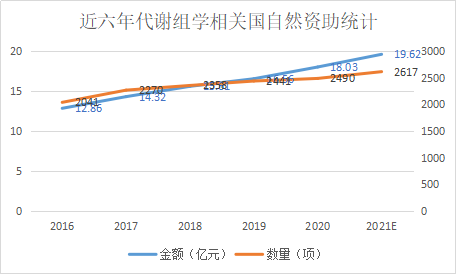
2020年代谢组学方向国自然简况
代谢组学作为组学领域的研究热点,近几年国自然资助的项目数和项目金额都保持了较好的增长。2020年代谢组学相关项目的数量达到2490项,金额高达18.03亿元。(依据公开资料整理,下同
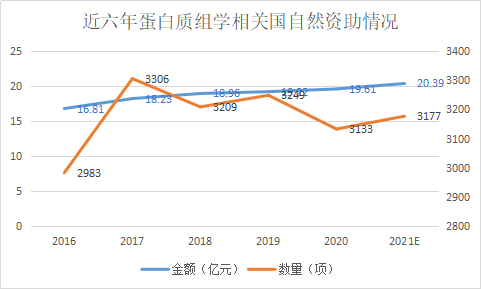
2020年蛋白质组学方向国自然简况
蛋白质组学作为组学领域经典的研究手段,近几年国自然的资助金额稳中有升,总体上保持了近20亿元的规模。相信国家每年在蛋白质组学基础研究中这么多的投入,蛋白质组学临床产品的产业化也是指日可待。
2020年,比较热门的宏基因组学和单细胞转录组学国自然的资助金额也分别达到了17.31亿元和27.04亿元。
2020年四大组学方向资助排行榜
2020年四大组学(包括代谢组学、蛋白质组学、宏基因组学、转录组学)去重后的总资助金额约为33.14亿元,总数量约为5633项。
各省获得的资助金额及数量如下:
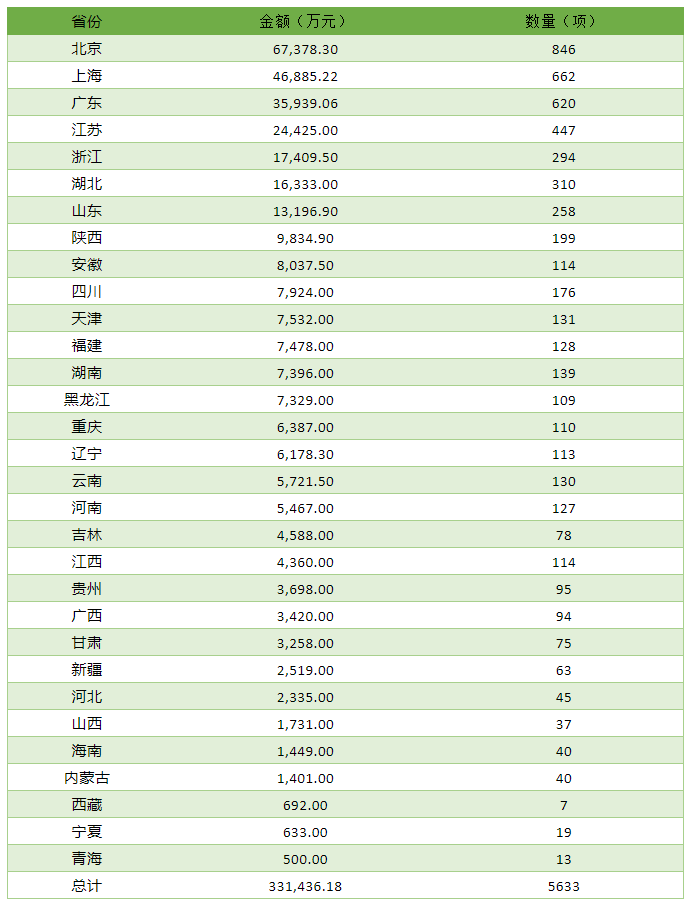
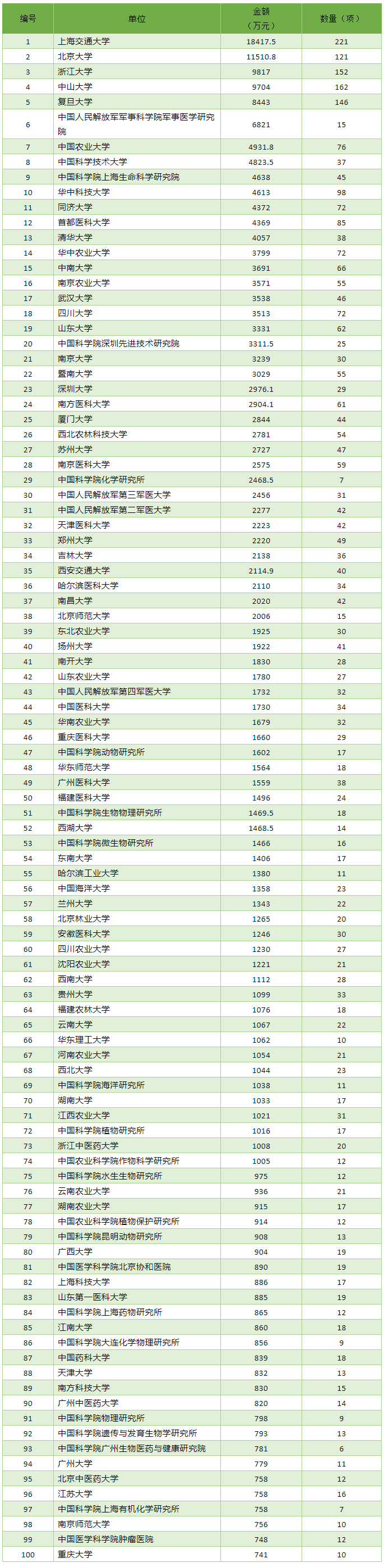
2020年国自然四大组学各单位资助金额前100名见下表。
结语
虽然国家自然科学基金的金额和数量每年都有所提升,但并不表示国自然的申请越来越容易,相反,国自然评审对于项目的创新性、质量等的要求越来越高。最近,小趣也有幸参与了一些国自然申请标书的讨论,和大家分享一个感悟:创新非创意,创新更多的是关注能否解决实际工作中发现的科学问题?是否能产生科学价值和科学成果?是否能有应用前景或解决卡脖子的技术问题?毋需盲目追求新的理论,新的学说及新的流派。
明天就是国自然提交的最后期限,在此提前恭贺获得国自然资助的各位老师,祝福大家科研顺利,Paper高发!









